Исследователи склонны всё больше и больше внимания обращать на воспалительные процессы в мозгу при дегенеративных заболеваниях, как в роли первопричины, так и в роли вторичного фактора, вызванного повреждением нервной ткани. Нейровоспаление может оказаться центральным процессов в старении организма.
Определить нейровоспаление в контексте нейродегенеративных заболеваний очень сложно, хотя, например, при рассеянном склерозе (аутоиммунное заболевание, не имеет ничего общего со склерозом в бытовом понимании) это не представляет затруднений. В последнем случае лимфоциты и моноциты в избытке проникают за барьер отделяющий нервную ткань от кровяного русла, вызывая нарушение функции.
С патологиями, включающими в себя болезнь Альцгеймера, которую вы вероятно знаете по состоянию писателя Терри Пратчетта перед его смертью, болезнь Паркинсона, от которой в последние годы своей жизни страдал художник Сальвадор Дали, боковой амиотрофический склероз, который стал известен в связи с состоянием физика Стивена Хокинга, описание ведётся по реакции, выраженной в изменении формы и структуры глиальных клеток – астроцитов и микроглии. Многие из подобных заболеваний проявляются в старшем возрасте, они связаны со старением и возможно вызваны им. Понимание нейровоспаления, его причин и последствий, может потенциально улучшить терапию многих заболеваний, некоторые из которых сейчас лечатся только симптоматически.
Для того, чтобы разобраться в феномене нейровоспаления, сперва необходимо понять, что такое воспаление. Предложенному вопросу уже более 2000 лет, но определения воспаления, которое привело бы учёных и врачей всего мира к консенсусу, не предложено до сих пор.
Что такое воспаление?
«Rubor, et tumor, cum calore et dolore». Покраснение, опухоль с жаром и болью, – так описывает воспаление древнеримский врач Корнелий Цельс. Этому определению недостаёт важных деталей, которые уточняет его коллега, хирург Гален, спустя около 100 лет после своего предшественника – functio laesa или нарушение функции.
В совокупности эти пять описанных признаков кратко передают всю сущность проявлений воспаления, и в практически неизменном виде доходят до наших дней. Студенты-медики до сих пор первым делом вспоминают латинскую скороговорку при ответе на экзамене.
Но нас такое определение категорически не устраивает, поскольку оно ничего не говорит о механизмах развития патологии и о её этиологии. С раскрытием деталей последней физиологам пришлось повозиться. История помнит множество теорий, которые в первую очередь касались роли сосудов в развитии воспаления, однако более существенное понимание появилось после того, как Илья Мечников обратил внимание на клетки, и вывел своё определение:
«Воспаление в своём целом должно быть рассматриваемо как фагоцитная реакция организма против раздражающих деятелей; эта реакция выполняется то одними подвижными фагоцитами, то с действием сосудистых фагоцитов или нервной системы».
Фагоциты, клетки, способные поглощать и разрушать вредные чужеродные частицы, были центральным фокусом работы Мечникова. Соответственно основной причиной для критики его определения стало отсутствие признания роли растворённых в жидкостях организма белков, которые, как теперь известно, имеют существенное влияние на процесс. Нам это определение импонирует по причине упоминания нервной системы, пускай Мечников и добавляет её только затем, чтобы признать нервную регуляцию сосудистой стенки, которая также модулирует течение воспаления.
С определением для нейровоспаления дела совсем плохи. Если открыть Википедию, то можно узнать, что «нейровоспаление – это воспаление нервной ткани». Вот такой вот circulus in definiendo, логическая ошибка при которой утверждение выводится из самого себя.
Интересное определение можно найти в редакторской колонке ACS chemical neuroscience, которое определяет нейровоспаление как неавтономноклеточные процессы, которые вызывают клеточную гибель, дисфункцию или восстановление нейронов и олигодендроцитов во время нейродегенеративного заболевания. «non-cell-autonomous processes which dictate CNS cell death, dysfunction, or recovery for neurons and oligodendrocytes during the course of neurodegenerative disease».
Это весьма неплохое определение, которое описывает плохую и хорошую стороны нейровоспаления, тем не менее ограничивает этот процесс рамками нейродегенеративного заболевания. Что же получается, до того, как у человека не заприметили Альцгеймера или Паркинсона, у него в мозге воспаления быть не может?
За этим вопрос определения остаётся открытым. Рассмотрим факты и интерпретацию исследований в этой области.
Зачем нужно воспаление?
Если бы не было регенерации, жизнь была бы невозможна.
Если бы всё регенерировало, невозможна была бы смерть.
«If there were no regeneration, there could be no life.
If everything regenerated there would be no death.»
- Richard Goss
В чём же суть воспаления? Friend or foe? – друг или враг? – как пишут международные научные издания и научно-популярные порталы в своём желании донести читателю всю сложность протекающих процессов описываемого явления.
Основная задача такого процесса как воспаление – сообщить организму об имеющемся повреждении или поломке. А организм уже «должен принять решение и действовать соответствующе». Чаще всего это решение принимается кооперативом из местных и системных иммунных клеток, которые сперва удаляют повреждающий фактор, а после сообща занимаются восстановлением гомеостаза пострадавшей ткани, насколько им это удаётся.
События принимают такой оборот, например, при травматическом повреждении нервной ткани. В первые моменты после неудачного стечения обстоятельств или запланированного лабораторного действия у позвоночных животных происходит массовая гибель клеток, затронутых травмой.
Первая волна смерти клеток вследствие некроза и апоптоза (запрограммированного суицида клетки, которая получила травмы несовместимые с жизнью) утихает через несколько часов, после чего за ней следует более продолжительная вторая волна, вызванная, вероятно, воздействием продуктов распада на окружающие ткани. При этом могут нарушаться взаимодействие нервной ткани и сосудистой, вследствие чего возникают перебои с поставкой энергии, ионов и необходимых веществ.
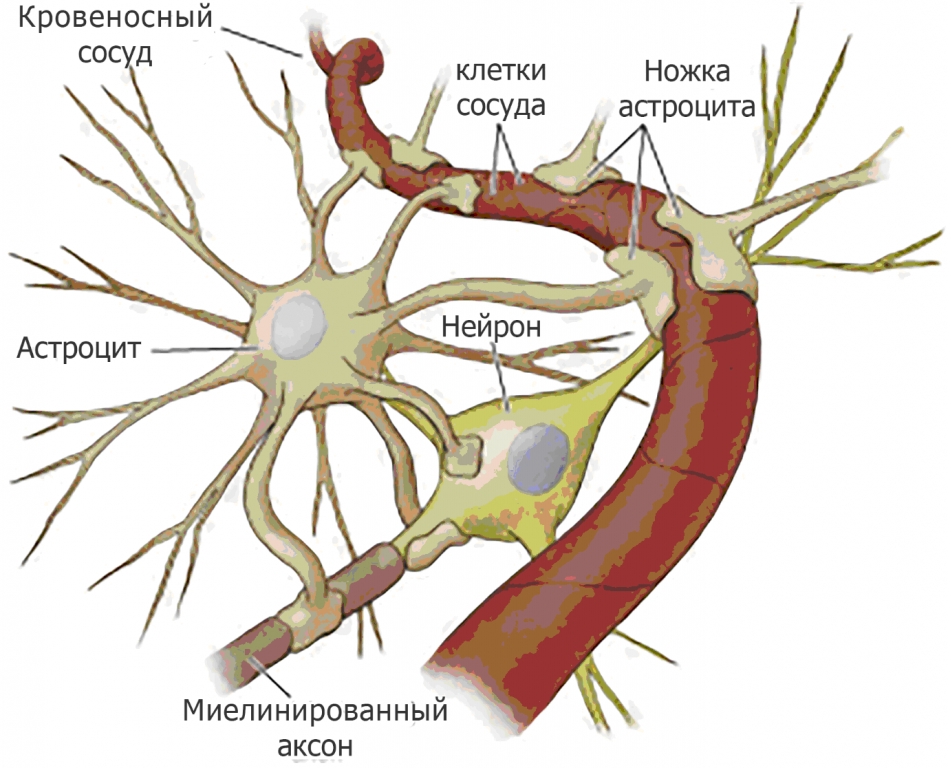
Активация микроглии в ответ на повреждение происходит незамедлительно. Микроглиальные клетки, эти крошечные макрофаги, непосредственно выполняют «фагоцитную реакцию организма против раздражающих деятелей», как это описывает Мечников.
Они постоянно зондируют окружающее пространство на предмет веществ, которые могут свидетельствовать о повреждении нейронов либо угрожать их целостности. В отсутствие подобных сигналов опасности активность макрофагов в нервной ткани подавляется пептидами, секретируемыми нейронами, которым оная не грозит. В противном случае – при появлении травмы – микроглия активируется в считанные минуты! Это отражается на их форме и функции. Клетки становятся более подвижными, могут начинать деление, выводить на внешнюю мембрану многочисленные рецепторы для более точной оценки обстановки. Активировавшись, они выбрасывают в межклеточное пространство белки системы комплемент и хемокины, которые привлекают в место повреждения большее количество иммунных клеток, цитокины, которые заставляют соседей реагировать на сложившуюся ситуацию, протеолитические ферменты для расщепления белков внеклеточного матрикса, увеличивая пространство для манёвра, а также активные формы кислорода и азота для того, чтобы распространить сигнал об опасности.
Астроциты не отстают от своих глиальных коллег. Будучи представлены самым многочисленным по количеству клеток классом в центральной нервной системе, они занимают стратегическое положение между эндотелиальными клетками сосудов и нейронами, регулируя работу барьера между кровью и мозгом. После травмы они реагируют либо на сигналы опасности, которые исходят от нейронов, либо на вещества, выделяемые активированной микроглией. Тогда астроциты увеличиваются в размере, гипертрофируясь, высвобождая нейрорегуляторные пептиды, например, BDNF (brain derived neurotrophic factor) или нейротрофический фактор мозга, который способствует выживанию повреждённых нейронов. Также они вырабатывают и секретируют фибриллярные белки, восстанавливающие внеклеточный матрикс и формируя глиальный рубец. С одной стороны это дело во благо, поскольку изолируется место повреждения, с другой стороны в этой области будет затруднена регенерация нейронов.
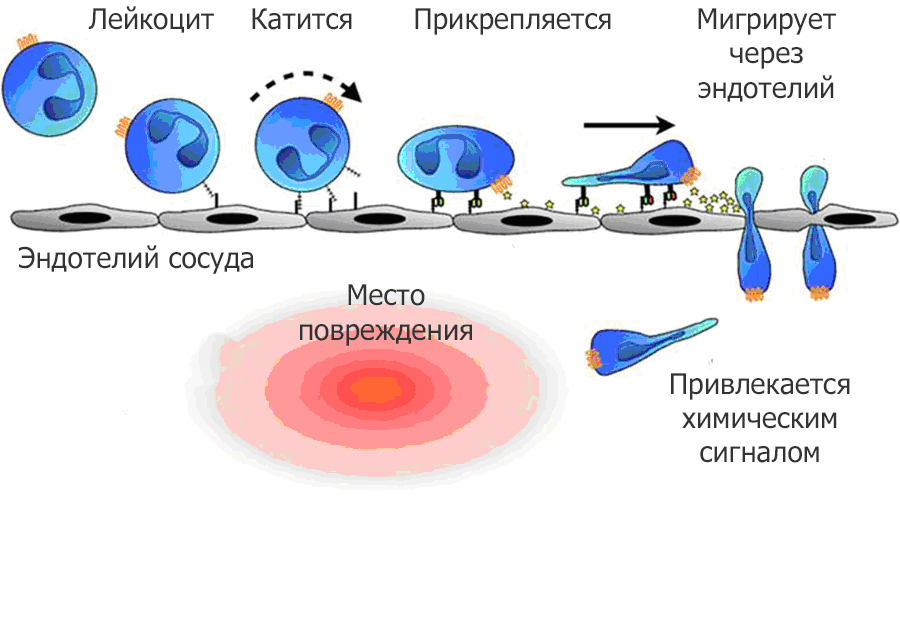
Миграция лейкоцитов к месту повреждения
Микроглия и астроциты играют роли первого плана при травматическом повреждении, тем не менее у этого сценария есть обширная массовка. В самое краткое время после повреждения на место действия буквально вкатываются лейкоциты (это их нормальный вид передвижения по эндотелию при воспалении). Из всего сонма лейкоцитов первыми прибывают нейтрофилы, которые начинают активно секретировать провоспалительные цитокины, активные формы кислорода и пептиды, которые склоняют клетки к апоптозу. Их пребывание в месте травмы временное, спустя 48 часов они уже не наблюдаются, тем не менее их появление является одним из важных ранних событий.
За ними происходит активация микроглии, рекрутируются Т и В лимфоциты, которые реагируют на белковые изменения, вызванные повреждением. На ранних стадиях к повреждению иногда также попадают эритроциты и тромбоциты. Они так же очень активно принимают участие в регуляции нейровоспаления, хоть это и происходит только при повреждении сосудистой стенки. Эти клетки вырабатывают фактор активации тромбоцитов, который участвует в регуляции микроглиальной активации, а кроме того, что может прозвучать неожиданным, являются дополнительным источником серотонина (он производится не только в пределах нервной системы, но и далеко за). Серотонин в данном случае способствует прекращению истечению крови из сосудов, выживанию нейронов и сохранению их пластичности. www.sciencedirect.com/…159118305786?…
Нервные клетки не восстанавливаются?
Как постулировал Сантьяго Рамон-и-Кахаль, основоположник современной нейробиологии, в начале XX века, нервные клетки во взрослом организме не восстанавливаются. Вы, должно быть, не раз слышали это утверждение в виде фразы «утраченные нервы не восстанавливаются». Однако, в 60х годах прошлого столетия Джозеф Альтман заявил об открытии деления нейронов в гиппокампах зрелых морских свинок.
Эти свидетельства взрослого нейрогенеза не были восприняты всерьёз вплоть до 90х годов прошлого века. Накопившиеся данные о нейрогенезе разных видов, включая приматов, привели к сдвигу парадигмы.
Исследователи подтвердили, что нейрогенез в действительности происходит в мозге различных взрослых животных, и в итоге нашли следы новообразовавшихся нейронов в мозге взрослого человека. Предполагается, что сотни таких клеток производится каждый день в гиппокампе, где помогают формировать память и новые навыки. Эта концепция широко принимается учёными, и вы даже можете найти диеты и специальные упражнения, которые предположительно усиливают его. Предсказуемо, вы можете даже найти TED talk об этом феномене. Вот только проблема: подобного обновления нейронов может на самом деле и не быть. Исследования, которые опровергают существование взрослого нейрогенеза, продолжают появляться вплоть до сегодня. Последнее такое крупное исследование было опубликовано 15 марта этого года в журнале Nature. В нём учёные из Института Калифорнии в Сан Франциско заключают, что им не удалось обнаружить хоть какие-нибудь следы в нескольких дюжинах гиппокампов, полученных из мозгов взрослых людей, которые завещали свои тела науке. По заявлению исследователей, они не нашли никаких признаков даже в наиболее хорошо сохранившихся образцах.
Как обычно, очень сложно доказать, что чего-то на самом деле нет, и многие учёные со скепсисом смотрят на результаты работы. Многие указывают, что подсчёт вёлся косвенно – по наличию белков, которые обычно производят молодые, недавно поделившиеся клетки. Эти белки могли с лёгкостью деградировать вскоре после смерти организма. Весьма вероятно, что дебаты продолжатся дальше, и последнее слово в этом вопросе будет поставлено только тогда, когда будут разработаны методики наблюдения за нейронами в мозге живых людей. В мозгу рыбки данио-рерио нейроны боковой стенки желудочков способны делиться, а после перемещаться в область поражения, формируя молодые нейроны на смену погибшим. Соответствующие клетки более близких нам мышей уже не способны на такой фокус, хотя будучи помещёнными в пробирку in vitro, способность восстанавливается. Считается, что именно микроокружение в месте травмы у столь высокоразвитых животных препятствует развитию новых нейронов.
При повреждении ткани микроокружение формируется за счёт продуктов распада белков и других макромолекул, из которых она состоит, а также из веществ, секретируемых окружающими клетками. Конкретные действия глиальных клеток и их роль в восстановлении сильно зависят от характера травмы. При избыточной и постоянной активации микроглии выделяемые ею вещества в высокой концентрации становятся токсичными для окружающих клеток, вырабатываемые цитокины нарушают работу нейронов; секретируемые астроцитами фибриллярные белки препятствуют образованию функциональных связей.
Высокое количество интерлейкина 1, одного из основных медиаторов воспаления, особенно его бета формы, в совокупности с фактором некроза опухоли, интерлейкинами 6 и 10, вырабатываемых в ЦНС при повреждении, может приводить к головной боли и мигрени.
При этом нужно помнить, что эти провоспалительные цитокины необходимы для восстановления пострадавшей ткани, несмотря на то, что они в свою очередь могут вызывать клеточную гибель и наносить вторичный урон ткани. Например, фактор некроза опухоли альфа токсичен для нейронов на начальных этапах воспаления, однако он способствует регенерации на более поздних стадиях.
Нейровоспаление при болезни Альцгеймера
Как очевидно следует из определения, данного выше, нейровоспаление – частый спутник нейродегенеративных заболеваний. Такие заболевания характеризуются потерей структуры, функции и числа нейронов.
Болезнь, впервые описанная немецким психиатром Алоисом Альцгеймером, как правило поражает людей старше 65 лет, хотя иногда встречаются и другие формы. С развитием болезни пациенты теряют способность запоминать информацию, а в крайнем случае теряют долговременную память, способность говорить, ориентироваться в обстановке и ухаживать за собой. Причиной многих когнитивных нарушений при данной патологии является дегенерация нейронов и синапсов, приводящая к атрофии коры головного мозга.
Микроглия в роли одного из основных участников нейровоспаления становится активной после воздействия одного из многочисленных стимулов, а именно гипоксии, травмы, инсульта наряду с такими факторами как вирусы, бактерии и токсины. Также клетки активируются при появлении амилоидных бляшек и скоплений тау белков. Именно эти два фактора – нейрофибриллярные клубки тау белка и нейровоспаление, – являются ключевыми признаками болезни Альцгеймера.
Активированная микроглия наблюдается в избытке в мозге больного при осмотре патологом post-mortem. По видимому в присутствии провоспалительных цитокинов макрофаги мозга теряют способность фагоцитировать внеклеточные накопления бета-амилоида, группой пептидов, образующих характерную бляшку. В дополнение к этому повышенная концентрация цитокинов, таких как интерлейкин 1 бета, препятствует образованию синапсов, что объясняет их потерю в патологическом процессе.
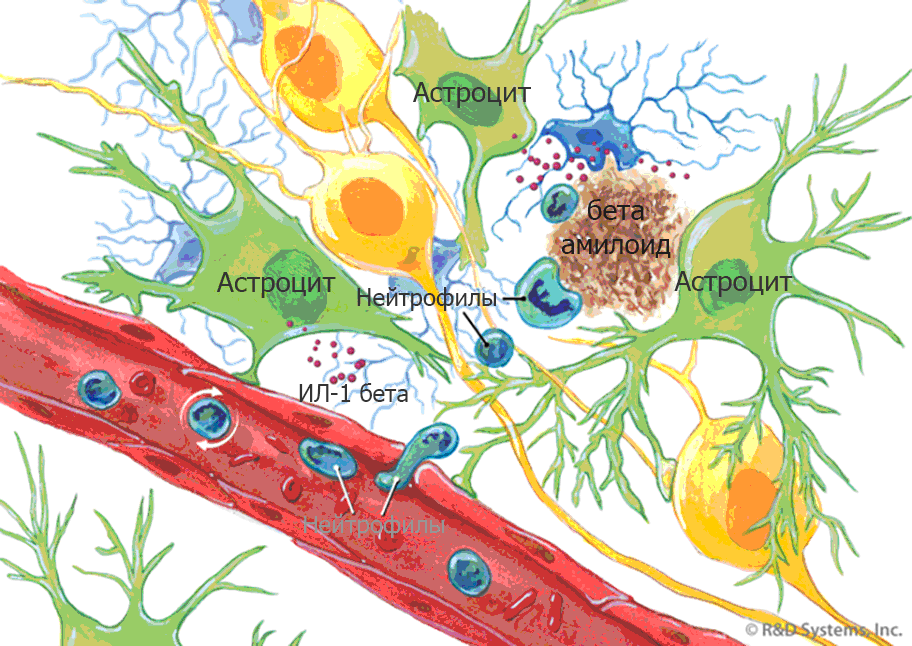
Нейровоспаление при болезни Альцгеймера
Учитывая колоссальный вред, наносимый мозгу хроническим воспалением, было сделано предположение, что вещества подавляющие воспаление могут лечить заболевание или хотя бы снижать вероятность его развития. Есть свидетельства, что нестероидные противовоспалительные средства (НПВС), такие как ибупрофен, могут сокращать воспаление, вызванное амилоидными бляшками, однако клинические испытания не были завершены ввиду высокого риска побочных явлений. На данный момент НПВС не считаются полезными в лечении болезни Альцгеймера, и ни одно из клинических испытаний по доказательству способности НПВС предотвращать или снижать риск развития заболевания не было закончено.
Результаты последних исследований в целом заставляют усомниться в пользе каждодневного приёма низких доз аспирина и потенциально других НПВС. Исследование, опубликованное в одном из самых влиятельных медицинских рецензируемых научных журналов Lancet, где врачи и учёные следили за более чем 12 000 пациентов с умеренным риском развития болезней сердца, не подтвердило никакой пользы в подобном приёме лекарства.
Нейровоспаление при болезни Паркинсона
Но что касается остальных нейродегенеративных заболеваний? При болезни Паркинсона, характеризующейся массовой гибелью нейронов базальных ганглиев, секретирующих дофамин, нейровоспаление является чуть ли не основным компонентом заболевания. Больные Паркинсоном люди теряют контроль над движениями, их руки начинают трястись, ухудшается почерк. Пациенты начинают ходить медленнее, у них возникают проблемы с ходьбой. Всё это ранние проявления заболевания. Со временем ухудшается абстрактное мышление и контроль внимания и появляются галлюцинации. Последние есть почти у 50% диагностированных. Ранние исследования мозга post mortem обнаруживают весь репертуар провоспалительных цитокинов, включая интерлейкины 1, 2, 6, интерферон гамма, фактор некроза опухоли альфа и другие. Тот же набор наблюдается в цереброспинальной жидкости больных. Также выявляются высокие концентрации оксида азота и супероксида, которые могут прямо и косвенно вызывать гибель нейронов.
Однако, несмотря на большие успехи в изучении представленной патологии, исследователи затрудняются сказать наверняка, является ли нейровоспаление причиной или следствием заболевания. Одно можно сказать наверняка: как только воспаление вовлекается в игру, оно становится ключевым игроком. Это подтверждается эпидемиологическими исследованиями. В отличие от болезни Альцгеймера, НПВС за исключением аспирина способны снижать риск развития болезни Паркинсона по данным мета-анализа, проведённого в 2010 году.
Характерной особенностью многих нейродегенеративных заболеваний является то, что риск их развития увеличивается с возрастом. Из этого можно предположить, что нейровоспаление и старение тоже как-то связаны.
Нейровоспаление при старении
Клетки мозга живут и умирают, это нормальный цикл жизни. Нейроны постепенно замещаются астроцитами, а выбрасываемые при их гибели цитокины контролируют воспаление и восстановление. Таким образом в любой выбранный момент времени в мозге присутствует определённый уровень провоспалительных цитокинов. Однако с возрастом маркеров воспаления в глие становится больше, а кроме того, они способствуют избыточному иммунному ответу при стимуляции. Микроглия становится гиперактивной. При старении также наблюдаются расстройства когнитивных функций – памяти, речи, абстрактного мышления, – хотя и в меньшей степени, нежели при нейродегенеративных заболеваниях. В целом старение можно считать основным риском мягких когнитивных расстройств. Пожилые люди часто показывают признаки когнитивных нарушений во время или после инфекции или стресса. Эти наблюдения подтверждаются в лабораторных экспериментах на мышах, когнитивные расстройства которых можно вызвать введением липополисахарида (компонента бактериальной стенки, на который развивается иммунный ответ), но которые можно ослабить, используя ресвератрол, сильный противовоспалительный агент.
Старение гиппокампа
Любое описание старения ЦНС неизменно начинается с гиппокампа, области мозга, отвечающей за формирование воспоминаний. Он оказывается затронут как при нормальном старении, так и при болезни Альцгеймера. В дополнение к памяти, гиппокамп интригует исследователей последствий стресса. Поскольку гиппокамп является важным элементом обратной связи, ответственным за прекращение выработки глюкокортикоидов, влияние хронического стресса на его старение находится под пристальным вниманием.
В ранних работах по изучению старения гиппокампа было показано, что у пожилых людей происходит значительная потеря количества нейронов. Однако в более поздних исследованиях с использованием точных техник физиологи нашли минимальные различия между числом нейронов в гиппокампах молодых и пожилых людей.
Очень похожая ситуация сложилась и с объёмом гиппокампа, измеряемым при помощи магнитно-резонансной томографии. Достоверно известно, что чем меньше объём гиппокампа, тем хуже будет память у пожилого человека. К счастью, есть исследования, которые показывают, что умеренные аэробные тренировки способствуют сохранению объёма гиппокампа.

Воздействие кортизола на отделы мозга при стрессе
Поскольку нейроны гиппокампа обладают значительным количеством глюкокортикоидных рецепторов, они уязвимы при долгом стрессе. У людей, которые страдают от тяжёлого и долговременного травматического стресса, гиппокамп атрофируется быстрее остальных частей мозга. Сходные эффекты наблюдаются при посттравматическом стрессовом расстройстве, шизофрении и депрессии. Интересно, что атрофию при депрессии можно замедлить приёмом антидепрессантов даже в том случае, если они не помогают справиться с другими симптомами.
Нейровоспаление при ментальных расстройствах
В целом вокруг депрессии образуется интересная картина. Причины её до сих пор неизвестны; наиболее популярная серотониновая теория постоянно подвергается критике. В то же время у пациентов с хроническим воспалением нередко обнаруживают признаки и симптомы депрессии. В этом году была опубликована работа, где учёные определили, что психологический стресс, вызванный в том числе социальными факторами, увеличивает уровень воспаления в мозге мышей. Мыши периодически встречались с агрессивно настроенным самцом на протяжении 10 дней. Подобный стресс вызывал повышение количества интерлейкина 1 и фактора некроза в опухоли, секретируемых активированной микроглией в префронтальной коре, областью мозга, которая ответственна за принятие решений. Подобное нарушение в итоге привело к эпизодам тяжёлой депрессии, которую удалось вылечить, нейтрализуя воспаление. Нарушение сна, описанное в экспериментальных условиях, вызывает активацию тех же рецепторов врождённого иммунитета, что и социальный стресс.
В связи с тем, что нейровоспаление может играть ключевую роль в психиатрических заболеваниях – депрессии, шизофрении, биполярном расстройстве, — этот феномен становится крайне любопытным, поскольку из результатов этих экспериментов вытекает вывод, что указанные заболевания можно предотвратить задолго до их появления коррекцией образа жизни, рациона питания и паттернов сна.
Старение гипоталамуса
В отличие от гиппокампа, изменения которого объясняют возникновение когнитивных расстройств с возрастом, гипоталамус возможно контролирует старение.
Эта структура в мозге, похожая на миндалинку, является мостиком между нервной и эндокринной системами организма человека. Она помогает регулировать поведение и многочисленные базовые потребности, такие как голод, сон, страх и агрессия. Соответственно с возрастом нарушается гомеостаз секретирующих нервных клеток, составляющих гипоталамус, и манифестируют проявления, ассоциированные со старением.
Первые поиски в этом направлении касались установления цепей обратных связей различных гормонов, часто половых. Однако нарушения обратной связи и возникновение резистентности к эстрогену, инсулину, гормону роста и другим регуляторным молекулам оказывается следствием, а не причиной. Клеточные и молекулярные механизмы, объясняющие потерю гомеостаза, всё ещё не изучены основательно.
За последние несколько лет было рассмотрено несколько молекулярных путей и генов, связанных с началом и прогрессией возраст-зависимых дегенеративных процессов. Среди них оказались очень популярные сейчас среди исследователей сиртуины, SIRT, белок мишень рапамицина млекопитающих, mTOR, транскрипционный фактор NF-kB и другие.
mTOR – это фермент, относящийся к семейству протеинкиназ, который является мишенью противоракового препарата рапамицина. В результате исследований на дрожах, червях, мухах и некоторых млекопитающих было показано, что рапамицин способен продлевать жизнь этих модельных организмов. Так mTOR заработал репутацию центральной, эволюционно консервативной детерминанты продолжительности жизни.
mTOR очень чувствителен к инсулину и факторам роста; он управляет метаболизмом клетки, её ростом и выживанием. Однако при хронической высокой стимуляции излишняя работа mTOR приводит к окислительному стрессу, накоплению повреждений и старению клетки – всем признакам воспалительного ответа клетки.
Активация транскрипционного фактора NF-kB способствует дальнейшему развитию воспалительной реакции, поскольку он контролирует гены, ответственные за её поддержание. В недавней научной работе было показано, что постоянный избыток калорий в пище может способствовать развитию воспалительных ответов в гипоталамусе.
Нейровоспаление при избытке питания
Избыток нутриентов обладает «эффектом домино». В первую очередь от него страдает эндоплазматический ретикулум – разветвлённая сеть полостей, пузырьков и канальцев, связанная с большим количеством метаболических функций: транспортом белков и липидов, накоплением кальция, и так далее. Когда этот важный органоид испытывает стресс в микроглие гипоталамуса, в этих клетках активируется NF-kB. Микроглиальные клетки находятся в непрерывной коммуникации с нейронами через провоспалительные цитокины, такие как фактор некроза опухоли альфа и интерлейкин 1 бета. Повышение их экспрессии активирует NF-kB в секретирующих нейронах, подавляя выработку гонадолиберина, гормона, контролирующего выработку гипофиза гонадотропных гормонов, и способствуя резистентности к инсулину и лептину. Со временем это неслабо расшатывает гомеостаз гипоталамуса. Это нарушение регуляции ассоциировано с системным старением и развитием возраст-зависимых патологий – диабета, ожирения, сердечно-сосудистых заболеваний, деменций и репродуктивной дисфункцией.
- www.ncbi.nlm.nih.gov/…s/PMC2586330
- www.ncbi.nlm.nih.gov/…s/PMC3756938
- www.ncbi.nlm.nih.gov/pubmed/23636330
- www.ncbi.nlm.nih.gov/…s/PMC4313775
Стволовые клетки и нейровоспаление
В 2013 году исследователи из Медицинского Колледжа имени Альберта Энштейна обнаружили стволовые клетки гипоталамуса, которые по их мнению также способны контролировать старение организма. Они сообщают, что количество стволовых клеток гипоталамуса снижается с течением времени у мышей, которые были объектом исследования. К двум годам – возрасту старых мышей – большинства этих клеток у них уже не остаётся.
Экспериментаторы пересадили стволовые клетки нормальным мышам, а также мышам, которым они заранее разрушили стволовые клетки гипоталамуса. Обе группы показали признаки замедленного старения. Оказалось, что ключевым эффектором в этом феномене, были специфические микроРНК. Эта группа молекул отличается от обычных РНК тем, что они не участвуют в процессе синтеза белков, а вместо этого участвуют в регуляции экспрессии других генов в клетках. Клетка может секретировать микроРНК в особых контейнерах – экзосомах.
Для подтверждения своей гипотезы экспериментаторы выделили экзосомы стволовых клеток гипоталамуса и сделали инъекцию в спинномозговую жидкость нормальным мышам и мышам, у которых были разрушены стволовые клетки гипоталамуса. Результат превзошёл все ожидания: снова обе группы мышей старели медленнее – у них оценивали мышечную силу, координацию движений, социальное поведение и когнитивные способности.
Хотя уже известны несколько микроРНК, которые играют важную роль в воспалении, такие как miR-107, miR-155 и miR-223, в данной работе не было изучено, какая именно микроРНК была ответственна за замедление старения. Исследования микроРНК находятся ещё только в начале пути и инсайты относительно того, как их можно будет использовать для увеличения продолжительности здоровой жизни, возможно ждут нас в недалёком будущем.
Заключение
Как теперь видно, нейровоспаление это крайне сложный процесс. При нём не наблюдается классических проявлений воспаления, описанных Цельсом, а именно покраснения, опухоли с жаром и болью. Тем не менее при нейровоспалении молекулярные и клеточные механизмы частично те же, что и при воспалении. И в том и другом случае участвуют сигнальные молекулы или цитокины, такие как интерлейкины, хемокины и фактор некроза опухоли. И тот, и другой процесс имеет положительную и отрицательные стороны.
Ключевым в этих процессах является попытка организма восстановить повреждённую ткань теми способами, которые ему доступны. Есть и отличия. Резидентными макрофагами в ткани мозга являются микроглиальные клетки. Они не обнаруживаются в других тканях организма. Вместо обычного шрама в нервной ткани образуется глиальный за счёт активации астроцитов.
Неудивительно, что воспаление в нервной ткани, особенно центральной нервной системы, имеет далеко идущие последствия. Нейровоспаление вовлечено в старение, возраст-зависимые патологии, ожирение и некоторые виды деменций.
Несмотря на то, что многое в здоровье зависит от генетики, наше поведение тоже отчасти определяет то, как мы будем жить и стареть. Умеренные физические нагрузки и, опять же, умеренное, здоровое и разнообразное питание, здоровый сон позволяют уменьшить нейровоспаление, а также продлить здоровье мозга и тела. Необходимо так же вовремя обращаться за помощью к врачам, даже если это «какая-то депрессия» и само пройдёт. А также не стоит увлекаться самолечением, и гаданием по пабмеду, которое пришло в наше общество на смену диагнозу по гуглу.
Автор: Василий Цветков. Источник(и): habr.com