Эксперименты с облучением плазмидной ДНК инфракрасным светом с длиной волны 2,2 микрона показали, что разрывы нитей ДНК происходят не реже, а чаще, чем в ближнем ИК-диапазоне. Молекулярный механизм такого процесса связан вовсе не с электронами, появляющимися при поглощении света, а с гидроксил-радикалами OH, которые при большой пиковой мощности излучения становятся вращательно-возбужденными и эффективно разрезают одну или обе нити молекулы ДНК.
Воздействие радиации на ДНК
Все, наверное, наслышаны, что радиация - то есть потоки фотонов, электронов и прочих частиц - опасна для всего живого. Более того, этот сугубо научный факт уже давно стал основой, на которой вырастают многочисленные и зачастую неоправданные страхи перед любыми словосочетаниями со словами «радиация» или «атомный». Между тем, до сих пор плохо понято, как именно радиация влияет на живые клетки, за счет каких конкретных молекулярных механизмов определенная доза ионизирующего излучения разрушает биологические молекулы (прежде всего, ДНК) и убивает живые клетки. В недавнем выпуске журнала Physical Review Letters появилась статья, сообщающая о новых и несколько неожиданных аспектах того, как инфракрасное излучение большой мощности разрушает молекулы ДНК. Не исключено, что эта работа потребует пересмотра критериев того, какие мощности на каких длинах волн в ИК-диапазоне должны считаться безопасными для здоровья.
Вообще, разрушение ДНК под действием облучения может происходить по разным причинам. Самая банальная - это тепловое воздействие, и именно оно первым делом приходит на ум, когда говорят про инфракрасное излучение. Большой поток излучения, попадающего в живую ткань, приводит к локальному энерговыделению, повышению температуры, из-за чего молекула ДНК расплетается или разрушается.
Но радиация может разрушать ДНК и тогда, когда поток излучения не настолько велик, чтобы существенно нагревать среду. В этом случае каждый отдельный электрон или фотон, поглотившийся в биологической жидкости в непосредственной близости от ДНК, порождает каскад молекулярных процессов, которые в конце концов приводят к разрыву одной или, реже, обеих нитей ДНК. Новая статья касается как раз этого, нетеплового, разрушения ДНК.
С точки зрения молекулярной физики, разрыв нити ДНК - это просто разрыв некоторых химических связей. Двойной разрыв - это два таких события на обеих нитях, произошедшие очень близко друг к другу. Если однократный разрыв еще можно починить, достроив молекулу по второй (комплементарной) нити, то двойной разрыв просто разрезает ДНК на части. В принципе, организовать такой разрыв несложно - надо лишь передать молекуле ДНК большую энергию, причем передать ее надо напрямую . Эта энергия вытащит из молекулы несколько электронов, химические связи в ней нарушатся, и нити смогут разорваться. Такие процессы начинаются выше порога ионизации ДНК, который составляет несколько десятков электронвольт. Для ионизирующего излучения высокой энергии это и есть основной механизм воздействия. Частица с энергией в мегаэлектронвольты за счет ионизации вещества производит на своем пути несколько тысяч электронов на каждый МэВ потерянной энергии, и каждый из этих электронов имеет шанс разорвать нить ДНК. Однако для частиц меньшей энергии такой разрыв за счет «грубой силы» уже не работает. Например, энергия одного оптического фотона составляет всего 2 эВ, что существенно меньше порога ионизации; энергия инфракрасных фотонов и того меньше. Кроме того, под действием излучения энергия гораздо чаще выделяется не непосредственно в молекуле ДНК, а в жидкости рядом с ней. Поэтому возникает вопрос о том, может ли эта (и без того небольшая!) энергия передаться ДНК, приводит ли она к разрыву нитей, и если да, то как именно это происходит.
Детальное изучение всех этих процессов началось не так давно, в 1990-2000-е годы. Выяснилось, что да, разрыв нитей может вполне эффективно идти и ниже порога ионизации ДНК, а сам механизм, с помощью которого низкоэнергетическая частица порождает такие разрывы, очень сложен и включает в себя разнообразные короткоживущие промежуточные состояния. Например, в 2000 году исследователи с удивлением обнаружили, что электроны с довольно небольшой энергией 8 эВ приводят к разрывам ДНК в несколько раз чаще, чем электроны с энергией в 13 эВ. Получается, действие электронов вовсе не сводится к простой передаче энергии для разрыва химических связей. Вместо этого электроны, образуя промежуточные отрицательно заряженные ионы, резонансно запускают некоторые молекулярные процессы, которые уже затем разрывают связи, а сами ионы быстро исчезают. Но даже если не принимать во внимание саму молекулу ДНК, а просто попытаться разобраться, что вообще происходит в воде на атомарном уровне, когда там возникает электрон с энергией несколько эВ (прилетевший извне или выбитый фотонами), то и здесь картина явлений оказывается очень богатой. Благодаря экспериментальным методам, появившимся в арсенале физиков не так давно, исследователи обнаружили, что один-единственный электрон приводит к целому каскаду сверхбыстрых молекулярных процессов, разворачивающихся на временном масштабе порядка пикосекунды.
В общем, молекулярные механизмы биологического эффекта радиации оказались чрезвычайно сложными; современное состояние дел для низкоэнергетических электронов описано в обзоре 2011 года.
Роль гидроксил-радикалов
Электроны, выбиваемые ионизирующим излучением, обычно считаются основным источником разнообразных проблем для ДНК. Однако дело не только в них. Три года назад было показано, что образующиеся под действием инфракрасного (ИК) света гидроксил-радикалы (молекулы OH) тоже играют важную роль в этом процессе. Это «обрывки» молекул воды, которые возникают при воздействии сильного светового поля. Вначале лазерный импульс порождает множество возбужденных (H2O*) и ионизированных (H2O+) молекул воды, которые затем сталкиваются друг с другом и обмениваются протоном: H2O* + H2O+ → OH + H3O+. Гидроксил-радикалы нестабильны, они с удовольствием отбирают атом водорода у окружающего вещества, если оно есть в наличии. Радикалы OH, образовавшиеся вблизи молекулы ДНК, доходят до нее и за счет многократных столкновений отбирают один из ее атомов водорода, превращаясь в молекулы воды. Потеря водорода в «остове» ДНК-нити приводит к перестройке химических связей и разрыву нити.
Чтобы это описание не казалось чистым теоретизированием, полезно пояснить, на примере той работы 2011 года и новой статьи, как экспериментаторы вообще выясняют, какой процент молекул ДНК испытывает разрывы и что в этом виновато - электроны или OH-радикалы.
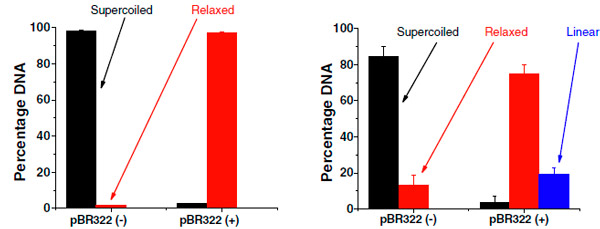
Для этого экспериментаторы используют плазмиды бактериальных ДНК - небольшие свернутые в кольцо кусочки молекулы ДНК, которые в своем обычном состоянии находятся в форме «суперскрученной» спирали (так называемая сверхспирализация ДНК). Способность к сверхспирализации - важная характеристика ДНК, помогающая компактному ее хранению и выполнению своих функций. Разрыв одной нити позволяет сверхспирали распутаться - она переходит в «расслабленную» форму; двойной разрыв превращает ее в линейную молекулу (рис. 1). Все эти три формы эффективно разделяются с помощью стандартной методики гелевого электрофореза(рис. 2), поскольку они «ползут» под действием электрического поля с разной скоростью. Поэтому, сравнив полосочки до облучения и после облучения, можно по их яркости узнать, какой процент сверхспирализованных плазмид приобретает расслабленную или линейную форму.
Для выяснения того, какой из молекулярных механизмов разрывает ДНК, экспериментаторы добавляют в раствор специальные вещества, которые быстро поглощают свободные электроны или свободные OH-радикалы, нейтрализуя их действие. Измеряя процент разрывов ДНК в зависимости от концентрации электрон-нейтрализующих или радикал-нейтрализующих агентов, можно сделать выводы относительно их роли в разрушении ДНК. Например, если электроны играют важную роль в разрушении ДНК, то при их нейтрализации количество разрывов сильно уменьшится. Если они не играют роли - оно не изменится.
Новая статья стала продолжением работы 2011 года, но уже с более длинноволновым излучением. Если тогда длина волны ИК-лазера была 0,82 мкм (ближний ИК-диапазон), то сейчас эксперименты проводились на длинах волн 1,35 мкм и 2,2 мкм. Эта область уже близка к среднему ИК-диапазону, который считается безопасным для здоровья и активно используется в многочисленных технических приложениях, в том числе и для передачи излучения по открытому воздуху. Параметры лазерного света, использованного в обеих работах, были близкими. Лазер выстреливает импульсы длительностью всего лишь десятки фемтосекунд и энергией порядка миллиджоуля каждый. Импульсы идут друг за другом тысячу раз в секунду, поэтому усредненная по времени мощность лазера получается небольшой. Однако из-за сверхмалой длительности импульса пиковая интенсивность света высока и достигает десятков ТВт/см2. Такое сильное электрическое поле в фокусе луча дополнительно разгоняет электроны, образовавшиеся при поглощении фотонов, а также стимулирует образование OH-радикалов.
|
Обычно считается правдоподобным, что чем более длинноволновое излучение мы используем, тем слабее - при фиксированной мощности - должны быть вызванные им эффекты, поскольку энергия отдельных фотонов становится меньше. Результаты новых экспериментов полностью противоречат этому предположению. Выяснилось, что излучение на длинах волн 1,35 мкм и 2,2 мкм разрушают ДНК сильнее , чем в предыдущих экспериментах с ближним ИК-светом. После трех минут облучения практически вся сверхспиральная ДНК в образце получила разрывы по крайней мере в одной нити (рис. 3). Более того, на 2,2 мкм существенная доля всех ДНК получает двойной разрыв и становится линейной (именно этот факт и подчеркивается на рис. 2 и 3).
Такая закономерность кажется, на первый взгляд, парадоксальной: энергия фотонов меньше, а биологический эффект от них сильнее. Однако авторы утверждают, что нашли молекулярный механизм этого эффекта. Поскольку гидроксил-радикалы появляются при столкновении возбужденных молекул воды, они сами по себе могут быть возбужденными. Вычисления, проведенные авторами, показали, что фотоны с длиной волны 2,2 мкм очень эффективно раскручивают OH-радикалы (эти радикалы переходят во вращательно-возбужденные состояния). Такие вращающиеся молекулы сильнее воздействуют на остов молекулы ДНК и более эффективно разрезают нити. Два близких столкновения ДНК с вращающимися OH-радикалами становятся более вероятными и приводят к полному разрыву ДНК.
Для доказательства того, что длинноволновое ИК-излучение действует на ДНК за счет OH-радикалов, а не электронов, экспериментаторы провели серию измерений с добавками нейтрализующих агентов с разной концентрацией. Выяснилось, что нейтрализаторы электронов практически не изменяют процент разрывов ДНК, а нейтрализаторы OH-радикалов резко его снижают. Более того, процент линейной ДНК падает с ростом концентрации OH-нейтрализатора гораздо быстрее, чем процент расслабленной. Это означает, что механизм двойного разрыва ДНК - это скорее всего не однократный удар OH по молекуле, сразу разрушающий обе нити, а два близких, но независимых удара, каждый из которых расщепляет свою нить. До сих пор этот вопрос не был проверен экспериментально.
Авторы завершают свою статью замечанием, что согласно современным медицинским критериям излучение с длиной волны больше 1,3 мкм считается безопасным, в том числе и для глаза. Однако они сейчас продемонстрировали, что такое излучение при достаточной пиковой мощности в лазерном импульсе может вызывать эффективное разрушение молекул ДНК, более сильное, чем излучение в ближнем ИК-диапазоне. Это, по мнению авторов, уже достаточная причина для того, чтобы обеспокоиться тем, насколько адекватны нынешние критерии безопасности. Конечно, в бытовых устройствах, использующих ИК-светодиоды (например, пульты дистанционного управления), такой пиковой мощности нет даже близко, поэтому паниковать смысла нет. Но, все же, в свете новых данных будет полезно тщательнее разобраться с тем, где именно проходит граница безопасности для здоровья в ближнем и среднем ИК-диапазоне.