Уже в который раз мы становимся свидетелями того, как биологический процесс, считавшийся ранее несущественным, на самом деле не только широко распространен, но и участвует в поддержании разносторонней деятельности организма. Так случилось, например, когда была осознана роль оксида азота в кровообращении (открытие, которое принесло его авторам Нобелевскую премию). Сегодня в центре внимания специалистов в области клеточной биологии оказался еще один процесс - аутофагия (аутофагоцитоз).
В своей основе аутофагия (от греч. autos - «сам» и phagos - «пожирающий») не представляет собой ничего сложного. Одной из составных частей любой клетки является цитоплазма, полужидкая субстанция, в которой суспендированы клеточные компоненты (органеллы) - ядро, митохондрии, рибосомы, комплекс Гольджи и другие. Каждая из них высвобождает в цитоплазму продукты своей «жизнедеятельности» - как полезные, так и вредные. Последние засоряют внутриклеточное пространство и мешают нормальной работе клетки. Их удаление и осуществляется в частности с помощью аутофагии.
Регулярное избавление от хлама важно для любой клетки, но в первую очередь - для клеток нервной системы (нейронов), поскольку они не подлежат замене и служат нам всю жизнь. Установлено, что аутофагия выполняет также защитные функции. Любой чужеродный агент - бактерия, вирус, вредные вещества, - попав в цитоплазму, сразу становится ее мишенью.
Правильное представление о работе системы аутофа гии не только поможет понять, как функционирует клетка, но и послужит основой в поиске лекарственных веществ, способных стимулировать или, напротив, подавлять ее. Контролируя скорость процесса и направляя его в нужное русло, можно корректировать действие лекарственных веществ и да же предотвращать некоторые возрастные нарушения в работе головног о мозга.
Скорая помощь и домохозяйка в одном лице
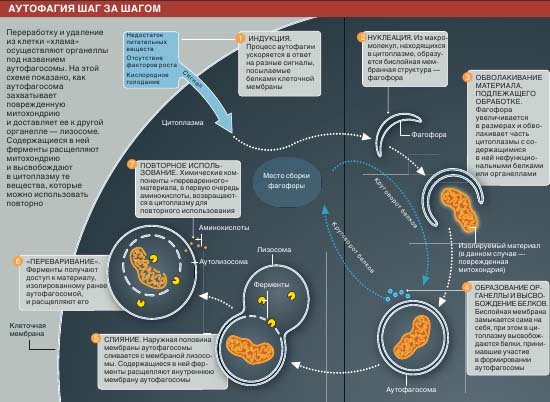
Работа системы аутофагии начинается с самосборки в цитоплазме бислойных мембран из белков и липидов (илл. на следующих стр.). Изгибаясь, мембраны окружают часть цитоплазмы вместе с содержащимися в ней веществами или органеллами, а затем замыкаются сами на себя, образуя глобулу - аутофагосому. Последняя сливается с лизосомой - « фабрикой» по переработке отходов - с образованием так называемой аутолизосомы. Содержащиеся в ней ферменты расщепляют на части «груз», доставленный аутофагосомой, при этом фрагменты молекул, подлежащие повторному использованию, высвобождаются в цитоплазму.
В общих чертах этот процесс как неотъемлемая составляющая клеточной активности был описан в 1960-х гг. Кристиа ном Де Дювом (Christian de Duve) с сотруд никами из Рокфеллеровского университета. А десять лет назад один из авторов данной статьи (Кленски), а так же Есинори Осуми (Yoshinori Ohsumi) и другие начали заниматься исcедованием системы аутофагии у дрожжей, где она устроена гораздо проще, чем у высших животных. Тогда удалось выяснить многие ее детали, что было особенно ценно, поскольку целый ряд белков, принимающих участие в ее работе или регуляции, аналогичны таковым у человека.
Аутофагия могла возникнуть в ходе эволюции как реакция на дефицит питательных веществ. Поясним, в чем тут дело. Как известно, в условиях голодания организм начинает использовать внутренние резервы. Вначале в ход идут жировые клетки, а в последнюю очередь - мышечные; их компоненты расщепляются и включаются в метаболические процессы, важные для поддержания жизни организма.
Точно так же поступают и клетки в отсутствие питательных веществ, разлагая на части некоторые свои компоненты во имя самосохранения. Аутофагосомы работают постоянно независимо от того, голодает клетка или нет. Но дефицит питательных веществ, кислорода или факторов роста стимулирует процесс сборки аутофагосом. Они «выуживают» из цитоплазмы белки и органеллы (на первый взгляд - независимо от их функционального статуса), которые можно было бы использовать как источник питательных веществ и энергии, столь необходимых клетке.
Сформировавшись в ходе эволюции как реак ция на дефицит питательных веществ, система аутофагии могла взять на себя функции «домохозяйки» в ответ на повседневные нужды клетки. Аутофагосомы помогают к летке избавляться от хлама - продуктов неправильного соединения обычных белков или белков, выработавших свой ресурс. Такие белки либо перестают функционировать, либо, что гораздо хуже, функционируют неправильно, и от них необходимо как можно скорее избавиться. Непрерывно работающая система аутофагии поддерживает концентрацию таких белков на безопасном уровне.
Аутофагосомы не только удаляют аномальные белки, но и отыскивают и изолируют повреж денные органеллы. Так, митохондрии, в норме обеспечивающие клетку энергией, могут посылать ей несвоевременные сигналы к запрограммированной гибели - апоптозу. И с такими митохондриями нужно что-то делать.
Апоптоз запускается в клетках по разным причинам и как правило играет положительную роль. Например, в организме человека все время образуется избыточное количество новых клеток, и эти лишние клетки нужно устранять. Далее, апоптоз необходим для избавления от старых клеток, которые должны самоустраниться и уступить место новым. Клеточный суицид играет положительную роль и при канцерогенезе, ограничивая бесконтрольное деление раковых клеток. Апоптоз включает целую цепочку сложных внутриклеточных событий, которые происходят строго согласованно под управлением многочисленных сигнальных молекул, поэтому его и называют запрограммированной гибелью.
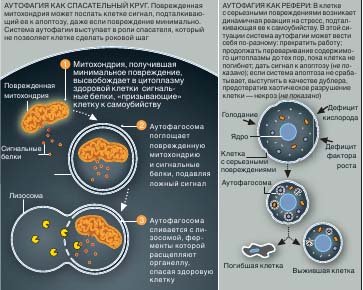
Но поврежденная митохондрия может послать сигнал к апоптозу необоснованно (илл. на стр. 48). Один из побочных продуктов ее деятельности - высокореакционноспособные кислородсодержащие молекулы (оксиданты), способствующие утечке в цитоплазму содержимого митохондрии, в частности сигнальных белков, запускающих апоптоз. Если клетка - нейрон, то ее гибель может иметь катастрофические последствия (в отличие, например, от клеток кожи, которые постоянно обновляются, и их утрата не несет никакой угрозы).
Аутофагия - надежный предохранитель от таких роковых сбоев. Аутофагосомы изолируют поврежденную митохондрию или другую органелл у и создают условия для ее деградации лизосомными ферментами, прежде чем она успевает послать клетке «убийственный» сигнал или дезорганизовать всю ее работу.
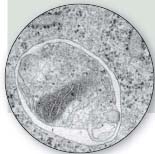 АУТОФАГОСОМА, ограниченная бислойной мембраной, «поглотила» митохондрию (в нижней части рисунка). Увеличено в 35 тыс. раз
АУТОФАГОСОМА, ограниченная бислойной мембраной, «поглотила» митохондрию (в нижней части рисунка). Увеличено в 35 тыс. раз
Митохондрии могут высвобождать оксиданты в цитоплазму, где они взаимодействуют со многими другими соединениями. В норме концентрация таких веществ в клетке под держивается на низком уровне с помощью антиоксидантов. Если в митохондрии возникают повреждения, то вредные вещества буквально наводняют клетку, и система дезинтоксик ации не успевает их обезвреживать. Такая ситуация чревата превращением нормальной к летки в раковую: оксиданты, проникнув в ядро, могут индуцировать серьезные повреждения в ДНК.
И вновь на помощь приходит система аутофагии, которая удаляет из клетки поврежденные митохондрии. Кроме того, как полагает Айлин Уайт (Eill en White) из Университета Рутгерса, благодаря работе этой системы уменьшается степень повреждения ДНК, что предотвращает раковую трансформацию клетки.
Обоюдоострое оружие
В ходе исследований, которые привели к разгадке тайны апоптоза, стало ясно, что этот путь самоуничтожения клеток не уникален, и кандидатом на роль еще одного механизма суицида стала система аутофагии. Нек оторые биологи даже считают, что а поптоз - это запрограммированная гибель клетки по типу I, а аутофагия - по типу II, хотя та кая схема принята не всеми.
Аутофагия может приводить к гибели клеток двумя путями. Первый из них состоит в неограниченном «переваривании» содержимого цитоплазмы вплоть до гибели клетки, второй заключается в стимулировании апоптоза. Но почему процесс, обычно предотвращающий преждевременную гибель клетки в результате сбоя в работе механизма апоптоза, вдруг превращается в свою противоположность и становится причиной ее разрушения? Однозначный ответ на этот вопрос пока не получен, но уже ясно, что он может оказаться весьма неожиданным. Есть подозрения, что апоптоз и аутофагия - два тесно связанных между собой и тщательно сбалансированных процесса. Предположим, что разрушение клеточных органелл идет слишком быстро, и аутофагия не может держать процесс под контролем. Тогда для блага организма клетке лучше всего умереть, и в ней запускается программа суицида - либо аутофагия «до победного конца», либо апоптоз. В настоящее время в этой области клеточной биологии наибольший интерес вызывают две пр облемы: как именно взаимодействуют между собой системы апоптоза и аутофагии, и можно ли рассматривать аутофагию как самостоятельный путь к гибели клетки.
Чтобы понять, является ли первоочередной задачей системы аутофагии поддержание клетки в жизнеспособном состоянии или она может помимо этого играть роль «ангела смерти», необходимо провести детальные исследования на молекулярном уровне. Недавно Бет Левайн (Beth L evine) из Юго-Западного медицинского центра Техасского университета и Гвидо Кремер (Guido Kroemer) из Национального центра научных исследований
| ВЫЖИВАНИЕ В УСЛОВИЯХ ГОЛОДАНИЯ
Аутофагосомы присутствуют в цитоплазме всегда, но в условиях дефицита питательных веществ их становится особенно много. Это приводит к ускорению переваривания аутолизосомами различных внутриклеточных компонент, в том числе интактных белков и других макромолекул, и высвобождению в цитоплазму питательных веществ для п овторно го использования. Дефицит последних служит сигналом к уменьшению объема клетки. Небудь в клетке системы своеобразного самопожирания - аутофагии, жизненно важные процессы в ней остановились бы, и она бы погибла
|
|
| КАК ПРИНИМАЕТСЯ ОКОНЧАТЕЛЬНОЕ РЕШЕНИЕ
Последний шаг серьезно поврежденной клетки - самоубийство во благо всего организма. Один из путей к этому, апоптоз, начинается с того, что поврежденная митохондрия высвобождает в цитоплазму сигнальные белки. Некоторые исследователи полагают, что уберечь клетку от рокового шага способна аутофагия. Но она же может привести клетку к гибели, когда это целесообразно с точки зрения организма в целом, а апоптоз не работает. Интересно, что обе системы используют в качестве сигналов целый ряд сходных белков. Это означает, что апоптоз и аутофагия действуют совместно и, возможно, их следует рассматривать как две составные части одной системы
|
|
Франции показали, как может осуществляться координация аутофагии и апоптоза. Один из белков, запускающих аутофагию, Beclin-1, связывается с другим белком, Bcl-2, который блок ирует начало апоптоза. Решение «жизнь или смерть» зависит от того, усиливается или ослабевает связь между этими двумя белками. О наличии связи между системами апоптоза и аутофагии свидетельствует тот факт, что фрагмент белка под названием Agt 5, играющего ключевую роль в образовании аутофагосом, может «находить дорогу» к поврежденной митохондрии и переключать систему ответа с чисто «аутофагической» на «апоптозную».
Как известно, благо при определенных обстоятельствах иногда превращается в свою противоположность, и аутофа гия не является исключением. Мы уже упоминали, что раковые клетки прибегают к ее помощи, чтобы выжить в стрессовых ситуациях. Часто целью химиотерапии является индукция суицида, одна ко в некоторых клетках вместо этог о активируется процесс аутофагии и поврежденные органеллы изолируются, не успев послать сигнал к апоптозу. Получается, что лучевая и химиотерапия могут стимулировать работу системы аутофагии.
Раковые клетки используют аутофагию в своих целях и для того, чтобы выж ить в условиях голодания. Подобные условия возникают, например, при недостаточном кровоснабжении опухолевой массы. В такой ситуации ра ковые клетки «подстегивают» аутофагию и используют продукты расщепления собственных макромолекул для поддержания своей жизнеспособности. Все это необходимо учитывать при выборе тактики лечения больных, которая должна включать подавление аутофагии в раковых клетках. Препараты, способные решить эту задачу, уже проходят клинические испытания. К сожалению, как отмечает Уайт, подавление аутофагии может сопровождаться накоплением мутаций, что чревато рецидивами болезни. С какой же ювелирной точностью должен работать врач-онколог, чтобы не навредить больному!
Аутофагия и нейродегенеративные расстройства
Выведение отработанного материала и получивших повреждение органелл имеет особенно большое значение для таких «долгожителей» нашего организма, как нервные клетки. Сбои в работе системы аутофагии причастны к развитию ряда нейродегенеративных расстройств - болезни А льцгеймера, хореи Гентингтона, паркинсонизма. Для всех этих патологий характерны медленные, но неотвратимые изменения в функционировании головного мозга, при этом наиболее распространенной является первая из них - только в США болезнью Альцгеймера страдает 4,5 млн человек.
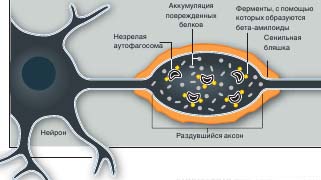
Одним из обычных проявлений старения организма является накопление в клетках головного мозга коричневатого материала под называнием липофусцин (он представ- ляет собой смесь липидов и белков). По мнению Ралфа Никсона (Ralph A.Nixon) из Института психиатрических исследований Натана Клайна, это служит знаком неспособности клеток головного мозга быстро выводить неправильно модифицированные или поврежденные белки. При болезни Альцгеймера желтоватый или коричневатый пигмент обнаруживается также в аксонах (длинных отростках) нервных клеток. В месте аккумуляции пигмента и образования амилоидной бляшки, характерного признака заболевания, аксон раздувается.
Почему образование а милоидных бляшек или их предшественников приводит к повреждению нейрона, до конца не ясно. Но, как показывают результаты недавних исследований, ферменты, способствующие формированию бляшек на ранних стадия х некоторых форм заболевания, локализуются на мембранах аутофагосом. По мнению Никсона, патологический процесс начинается с нарушения работы системы аутофагии (илл. вверху). Об этом, в частности, свидетельствуют электронно-микроскопические наблюдения: в клетках головного мозга пациентов, страдающих болезнью Альцгеймера, содержится очень много незрелых аутосом, которые локализуются именно в примыкающих к бляшкам частях нейрона.
Из всего сказанного следует, что любой способ налаживания работы системы аутофагии должен положительно сказаться на состоянии больного. И относится это не только к болезни Альцгеймера, но и к хорее Гентингтона. Обнаружилось, что лекарственный препарат рапамицин (сиролимус), который используется в качестве иммуно-
|
У пожилых людей аутофагосомы, присутствующие в нейронах, формируются не до конца. Поврежденные белки скапливаются в аксоне (длинном отростке, идущем от тела нервной клетки), и он раздувается. Ферменты (желтые), которые расщепляют белки на фрагменты (бета-амилоиды), по-видимому, локализуются на незрелых аутофагосомах, а сами фрагменты - на наружной поверхности аксона (оранжевый). Агрегаты бета-амилоидов (сенильные бляшки) являются характерным признаком болезни Альцгеймера, что наводит на мысль о связи данного заболевания с поломкой системы аутофагии
 |
|
супрессанта при трансплантации органов, стимулирует аутофагию. В настоящее время он проходит проверку на способность удалять белковые агрегаты из клеток больных хореей Гентингтона.
Аутофагия и патогенные микроорганизмы
Если аутосома изолирует и разрушает поврежденные митохондрии, возможно ли, что она поступает точно так же и с проникшими в клетку патогенами? Недавно эта гипотеза подверглась экспериментальной проверке. Один из авторов статьи (Детерик) и почти одновременно две группы я понских биологов, одну из которых возглавлял Тамоцу Есимори (Tamotsu Yoshimori ) из Университета Осаки,
|
| ОБ АВТОРАХ
Войо Деретик (Vojo Deretic) - профессор, заведующий кафедрой молекулярной генетики и отделом микробиологии Научного центра здоровья Университета штата Нью-Мексико. Учился в Белграде, Париже и Чикаго. Аутофагия интересует его и как фундаментальное биологическое явление, и как часть системы врожденного и приобретенного иммунитета. Дэниел Кленски (Daniel J. Klionsky) - проф ессор Института наук о жизни Мичиганского университета. Стипендиат Фонда Гугенхайма и Национального научного фонда. Главный редактор журнала Autophagy.
|
вторую - Тихиро Сасакава (Chihiro Sasakawa) из Токийског о университета, показали, что система аутофагии действительно выводит из клеток целый ряд патогенов. Сред и них - Mycobacterium tuberculosis, возбудитель туберкулеза, который уносит ежегодно 2 млн жизней по всему земному шару; бактерии Shigella и Salmonella, вызывающие кишечные заболевания; стрептококки группы А; Francisella tularensis, основное оружие биотеррористов; паразиты, например Toxoplasma gondii. Но точно так же, как раковые клетки, некоторые патогены извлекают пользу из «сожительства» с аутофагосомами. Так, Legionella pneumophila, возбудитель болезни легионеров, легко проникает в клетки человеческого организма и, попав в аутофагосому, может отсрочить или даже блокировать ее слияние с лизосомой. Таким образом, вместо того чтобы выполнять функции переносчика материала, подлежащего уничтожению, аутофагосома служит бактерии убежищем, где она может размножаться, используя вещества, которые содержатся в захваченной аутофагосомой цитоплазме.
Само существование такой изощренной эволюционной тактики однозначно указывает на то, что система аутофагии долгое время была основным барьером на пути проникновения патогенов в клетку - барьером, который в ходе эволюции они научились преодолевать.
|
| Некоторые микроорганизмы научились использовать систему аутофагии в своих целях. Вирус иммунодефицита человека ускоряет процесс аутофагии в неинфицированных клетках иммунной системы, что способствует их гибели |
Еще одним примером использования аутофагии в своих целях служит тактика, к которой прибегает вирус иммунодефицита человека (ВИЧ). Как показывают исследования, которые провели две группы биологов из Франции, ВИЧ, поражающий T-клетки иммунной системы CD4+, может повышать частоту гибели неинфицированных соседних клеток того же типа. Как только вирус проникает в клетку, он сбрасывает наружную оболочку, и составляющие ее белки индуцируют неконтролируемую аутофагию, а затем апоптоз окружающих клеток. Тем самым уменьшается число здоровых CD4+-T-клеток, и в конце концов развивается СПИД.
Связь с иммунной системой
Система аутофагии не только сама устраняет патогенные микроорганизмы, она также принимает участие в иммунном ответе на них. Например, аутофагосомы помогают в доставке самих патогенов или их белков к так называемым Toll-подобным рецепторам, которые являются частью системы врожденного иммунитета. Роль аутофагосом в этом процессе состоит в совершении хитроумной топологической инверсии. Дело в том, что патогенный микроорганизм, находясь в цитоплазме, может избежать встречи с Toll-подобным рецептором, поскольку сайт связывания последнего экспонирован либо наружу, во внеклеточное пространство, либо внутрь какого-либо компартмента клетки. Аутофагосома поглощает микроорганизм или его компоненты из цитоплазмы и доставляет их к компартменту, в мембране которого присутствуют Toll-подобные рецепторы. Встреча с ними молекул патогена приводит к индукции синтеза интерферона, который подавляет репликацию микроорганизма. Эта система врожденного иммунитета включается мгновенно, она не подразумевает выработки клеткой высокоспецифического ответа.
Аутофагосомы участвуют также в работе другой составляющей иммунной системы, так называемой системы адаптивного иммунитета. Например, если вирусу, проникшему в цитоплазму, удается переключить клетку на синтез своих белков, то аутофагосома поглощает их и доставляет к другому клеточному компартменту, в мембрану которого встроены молекулы, называемые МНС класса II. Оказавшись внутри такого компартмента, вирусные белки подвергаются частичному расщеплению. Их фрагменты связываются с МНС II, и образовавшийся комплекс перемещается к клеточной поверхности. Сразу вслед за этим система адаптивного иммунитета приступает к выработке ответа гораздо более специфического и действенного, чем ответ системы врожденного иммунитета.
Долгая жизнь?
Система аутофагии помогает отсрочить старение организма. Общеизвестно, что с возрастом частота многих заболеваний человека, прежде всего рака и нейродегенеративных расстройств, увеличивается. Отчасти это связа но с ухудшением работы системы очистки: в клетках накапливаются поврежденные органеллы, нефункционирующие белки и другие отходы, и многие жизненно важные процессы затормаживаются.
По мнению Анны Марии Куэрво (Anna Mar ia Cuervo) из Медицинского колледжа имени Альберта Эйнштейна, это объясняет тот факт, что исключение из рациона экспериментальных животных калорийных продуктов увеличивает продолжительность их жизни. Напомним, что дефицит питательных веществ повышает эффективность работы системы аутофагии, и ограничение в пище помогает клеткам поддерживать работоспособность. Более того, недавно показано, что сохранение в рабочем состоянии систем очистки организма от шлаков предотвращает аккумуляцию белков, получивших повреждения в результате взаимодействия с оксидантами.
Исследования механизмов аутофагии развивается в самых р азных, порой неожиданных направлениях, но пока мы на ходимся только в начале пути. Научившись стимулировать или подавлять аутофагию, мы, возможно, сможем влиять на ход многих патологических процессов и даже замедлять старение организма.
Перевод: Б.В. Чернышев
НОВОЕ ОРУЖИЕ В БОРЬБЕ С БОЛЕЗНЯМИ
Стимулирование, подавление и любые другие воздействия на систему аутофагии могли бы стать еще одним полезным инструментом в арсенале клиницистов. Здесь перечислены лишь некоторые заболевания, при которых использование этого инструмента представляется целесообразным
Источник
 АУТОФАГОСОМА, ограниченная бислойной мембраной, «поглотила» митохондрию (в нижней части рисунка). Увеличено в 35 тыс. раз
АУТОФАГОСОМА, ограниченная бислойной мембраной, «поглотила» митохондрию (в нижней части рисунка). Увеличено в 35 тыс. раз 










