По данным Всемирной организации здравоохранения, в 2000 году доля людей старше 60 лет составляла около 10% от общечеловеческой популяции и, по прогнозам, к 2050 году составит 22%. Такая тенденция присуща в большей степени развитым и развивающимся странам благодаря современной медицине и разумной политике здравоохранения. В то же время «жить дольше» всё еще не означает «жить лучше»: пожилые люди часто болеют, вынуждены постоянно принимать лекарства. Так, среди людей старше 65 лет смертность от гриппа выше 80% [2]. Прививки оказываются неэффективными, возрастает риск развития аутоиммунных заболеваний. Пожилые люди часто страдают аутоиммунными заболеваниями. Всё это говорит о том, что с годами в иммунной системе накапливаются какие-то ошибки. И если бы эти ошибки можно было исправить, то качество жизни пожилых людей улучшилось бы. За прошедшие годы собрано большое количество теоретических данных о молекулярных и клеточных механизмах старения иммунитета. Информации по этому вопросу накопилось достаточно много, и сейчас на вопрос «Можно ли омолодить иммунитет?» ученые дают обнадеживающий ответ.
Врожденный и приобретенный иммунитет
В основе иммунитета лежат три события - проникновение инфекции внутрь организма, затем распознавание «врага» и, наконец, уничтожение его (или хотя бы обезвреживание). Иммунитет традиционно разделяют на врожденный и приобретенный. Врожденным иммунитетом мы обладаем независимо от того, сталкивались ли ранее с инфекцией или нет. Исследования старения такого иммунитета в настоящее время ведутся, но результаты пока противоречивы. Приобретенный, или адаптивный, иммунитет - это способность обезопасить себя от чужеродных микроорганизмов или токсинов при условии, что организм уже сталкивался с этими объектами. То есть помимо распознавания и уничтожения «чужого» включаются механизмы памяти. Это означает, что клетки, уже столкнувшиеся с инфекцией, должны каким-то образом сохраниться и в случае повторной инфекции распознать ее и уничтожить быстрее и эффективнее. На свойстве памяти основан и принцип работы вакцины - в организм вводятся ослабленные или мертвые микроорганизмы, или только молекулярные «бейджики», которые носит тот или иной вид микроорганизма на поверхности. Именно по этим специальным «бейджикам», или, выражаясь научным языком, антигенам, клетки иммунной системы распознают, «свой» это или «чужой». Как мы уже упоминали, у пожилых людей часто встречаются аутоиммунные заболевания, повышена восприимчивость к инфекциям, а вакцины неэффективны. Далее мы узнаем, что эти на первый взгляд не связанные проблемы имеют много общего.
Роль Т-лимфоцитов в иммунном ответе
Мы не будем подробно рассматривать механизмы работы всех клеток иммунитета - на эту тему написаны увесистые книги, с каждым годом информации становится всё больше. Иммунный ответ - это всегда спектакль с большим количеством действующих лиц. Рассмотрим самый общий сценарий. Инфекция попадает в организм - это может быть вирус, попадающий внутрь здоровой клетки, или микроорганизм. Клетки врожденного иммунитета реагируют первыми - они захватывают клетки, пораженные вирусом, или сам микроорганизм и выставляют на своей поверхности антиген.
Затем другие клетки иммунитета, называемые наивными Т-лимфоцитами («наивный» значит «сталкивающийся с антигеном впервые»), получают с помощью выставленного антигена сигнал к действию.
На поверхности у Т-лимфоцитов есть специальные рецепторы, способные распознавать антигены. Эти рецепторы так и называются: Т-клеточные рецепторы (TCR). Биологически механизм распознавания Т-клетками - это связывание подходящего TCR и антигена. Представьте себе, что к не слишком надежному замку подходит несколько ключей-отмычек - примерно так же происходит захват антигена Т-клеточным рецептором. TCR может связывать несколько антигенов, и, наоборот, антиген может быть связан несколькими TCR.
После того как наивный Т-лимфоцит повстречался с инфекцией, он становится активированным: начинает активно делиться. При этом часть его клонов превращается в так называемые эффекторные клетки, остальные - в клетки памяти. Эффекторные клетки либо вырабатывают специальные молекулы, активирующие другие клетки иммунитета (Т-хэлперы), либо убивают пораженные клетки (Т-киллеры). Клетки памяти сохраняются и в случае повторной встречи с той же инфекцией обеспечивают более эффективный иммунный ответ.
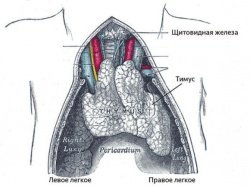
Деградация тимуса
Т-лимфоциты рождаются в тимусе - особом органе иммунной системы. Он расположен в верхней части грудной клетки.
С возрастом тимус деградирует. Этот процесс, называемый инволюцией, начинается в период полового созревания, и к старости ткань тимуса почти полностью замещается жировой тканью. Вместе с деградацией тимуса значительно уменьшается и почти полностью останавливается выработка Т-лимфоцитов. По последним данным, выход Т-лимфоцитов из тимуса, пусть и очень небольшой, сохраняется даже у людей, достигших 100 лет [3].
Тимус новорожденного. Рисунок из «Анатомии Грея» (изд. 1918 года). С годами тимус значительно уменьшается в размерах
Чем долгожители отличаются от простых смертных?
С годами тимус производит всё меньше клеток, но разнообразные инфекции атакуют человека на протяжении всей его жизни. Поэтому запас наивных Т-клеток, способных бороться с новыми инфекциями, постепенно исчерпывается.
К тому же в организме происходят постоянные случайные встречи наивных Т-клеток и вирусов, присутствующих в организме человека постоянно.
Одним из таких вирусов является цитомегаловирус (CMV). Заражение этим вирусом часто происходит незаметно или выражено как обычное ОРВИ. При этом более 90% людей во всем мире являются его носителями и имеют в крови антитела к нему. После встречи наивного Т-лимфоцита и CMV происходит активация Т-лимфоцита и нарастание популяции клонов, специфичных к этому вирусу. Постепенно происходит заполнение физиологических ниш такими клонами, а так как количество иммунных клеток в организме регулируется с помощью обратной связи, происходит уменьшение выработки новых иммунных клеток. То есть организм получает сигнал о том, что иммунных клеток достаточно много и можно их больше не производить. При этом почти все эти клетки оказываются бесполезными.
Замечателен тот факт, что у людей, преодолевших порог в 70 лет, больше наивных Т-клеток и разнообразней набор Т-клеточных рецепторов по сравнению с людьми, которым еще не исполнилось 70 лет. Также у долгожителей менее выражены популяции клеток-клонов - то есть клеток, произошедших от одного активированного Т-лимфоцита. Возможно, именно эти особенности иммунитета позволяют долгожителям лучше справляться с инфекциями и быть более здоровыми. С другой стороны, возможна также «селекция» - люди с пониженным иммунитетом, к сожалению, реже становятся долгожителями [4].
Аутоиммунные заболевания
В начале статьи было заявлено, что накапливаемые с возрастом аутоиммунные заболевания и ослабленный иммунитет могут иметь общие причины. И причины эти уже несколько раз упоминались - инволюция тимуса и разрастание популяций клеток, произошедших от одной однажды активированной клетки. Стоит еще раз оговориться: иммунитет - это очень сложная система, и мы рассматриваем самый общий случай, используя как можно меньше специальных слов. Таким образом, наша история имеет всего пять действующих лиц: тимус, Т-лимфоциты (Т-киллер, Т-хэлпер), Т-клеточные рецепторы (TCR) и антигены. Но здесь мы познакомимся с еще одним типом клеток - регуляторными Т-клетками.
Все клетки в организме носят на себе опознавательный знак, и, к сожалению, некоторые Т-лимфоциты могут воспринимать их как антиген. Некоторые органы изолированы от общего кровотока и никогда не сталкиваются с Т-лимфоцитами, например, щитовидная железа. Но если произошла травма и иммунные клетки крови столкнулись с клетками щитовидной железы, первые выработают иммунный ответ против вторых.
Это произойдет потому, что клетки щитовидной железы носят такие метки, которых клетки иммунной системы еще не видели и воспринимают как «чужие», то есть как антигены. Остальные органы не защищены подобной капсулой, и в норме тимус убивает Т-лимфоциты, TCR которых может воспринимать метки на клетках хозяина как антигены. Но всё же небольшое количество Т-лимфоцитов, враждебных организму, тимус упускает - и они блуждают где-то на периферии. Их действие сдерживают механизмы подавления (супрессии) - специальные Т-регуляторные клетки. Они тоже рождаются в тимусе. С возрастом тимус производит всё меньше регуляторных клеток, и случайные Т-клетки, направленные против организма хозяина, активируясь, вырабатывают полноценный ответ. Как уже известно, активированный Т-лимфоцит активно делится и, таким образом, популяция клеток, направленная на уничтожение ткани хозяина, становится через какое-то время внушительной.
Методы омоложения иммунитета
Итак, мы подобрались к ответу на вопрос, поставленный в начале статьи: можно ли омолодить иммунитет и как это можно сделать. Мы увидели, что основной причиной старения иммунитета, со всеми вытекающими последствиями, является возрастная инволюция тимуса.
Уже с конца 80-х годов прошлого века известно, что инволюция тимуса напрямую связана с половыми гормонами, начинающими активно вырабатываться в пубертатный период. Множественные исследования [5, 6] показали, что у мышей, кастрированных до полового созревания, улучшается работа тимуса. Более того, количество клеток-предшественников Т-лимфоцитов, снизившееся с годами, нормализуется после кастрации [7]. Дело в том, что все субпопуляции тимоцитов (незрелых Т-лимфоцитов), а также стромальные клетки тимуса (то есть клетки, которые создают для тимоцитов необходимое для развития окружение) имеют рецепторы к половым гормонам и у женщин, и у мужчин.
Устранение половых гормонов можно произвести не только хирургическим путем, но и назначением препаратов, например, аналогов гонадолиберина - гормона, стимулирующего активность семенников.
Другой вариант омоложения тимуса - использование сигнальных молекул, необходимых для создания тимоцитов в тимусе: цитокинов и факторов роста. Более того, можно каким-то образом влиять на биологические механизмы, с помощью которых регулируется спектр цитокинов в тимусе (то есть не вводить сами сигнальные молекулы, а каким-то образом заставить клетки производить нужные).
В 2013 году были проведены клинические испытания действия KGF (фактора роста кератиноцитов) на функции тимуса у взрослых (18-50 лет), результаты оказались достаточно обнадеживающими (NCT01712945). Еще один интересный факт (и мы его упоминали в начале статьи) состоит в том, что с возрастом ткань тимуса заменяется жировыми клетками. При этом тимус довольно хорошо восстанавливается при низкокалорийной диете. Способствует этому, скорее всего, «гормон голода» - грелин (ghrelin) [8]. Таким образом, терапия может быть двух типов: низкокалорийная диета либо употребление препарата грелина.
Заключение
Итак, возрастное ослабление иммунной системы, являющееся причиной низкой устойчивости к инфекциям (и невосприимчивости к вакцинам) и аутоиммунных заболеваний, происходит в первую очередь из-за старения тимуса. Тимус начинает деградировать на первом году жизни, но заметен этот процесс становится в период полового созревания, как ответ на повышенную выработку половых гормонов - и этот факт заставляет задуматься.
Возможно, в этом явлении заложен глубокий философский смысл: мы должны стареть и умирать, чтобы дать жизнь следующему поколению. И это, безусловно, прекрасно. Но, с другой стороны, старение тимуса можно обратить, и самый простой способ - снизить количество потребляемой пищи.
Хочется немного отвлечься от биологии и задуматься о связи «сексуальность - пища»: эти понятия уже давно связаны в искусстве, и в частности, в литературе. Например, у Пушкина о знаменитом шампанском в «Евгении Онегине» говорится так:
Аи любовнице подобен
Блестящей, ветреной, живой
И своенравной и пустой…
И тут биология опять подбрасывает нам пищу для размышлений: оказывается, как было показано в экспериментах на мышах, грелин, «гормон голода», оказывающий положительное влияние на иммунитет, ослабляет сексуальное поведение [9, 10].
1. Dorshkind K, Montecino-Rodriguez E, Signer RA. The ageing immune system: is it ever too old to become young again?Nat Rev Immunol. 2009 Jan;9(1):57-62.http://www.nature.com/nri/journal/v9/n1/full/nri2471.html
2. Trzonkowski, P., Mysliwska, J., Pawelec, G. &Mysligwsi, A. From bench to bedside and back: the SENIEUR protocol and the efficacy of influenzavaccination in the elderly. Biogerentology 19 Jun2008 (doi:10.1007/s10522‑008‑9155-9155).http://link.springer.com/article/10.1007%2Fs10522-008-9155-5
3. Jamieson, B. D. et al. Generation of functional thymocytes in the human adult. Immunity 10,569-575 (1999). http://www.cell.com/immunity/abstract/S1074-7613(00)80056-4
4. Britanova OV, Putintseva EV, Shugay M, Merzlyak EM, Turchaninova MA, Staroverov DB, Bolotin DA, Lukyanov S, Bogdanova EA, Mamedov IZ, Lebedev YB, Chudakov DM. J Immunol. Age-related decrease in TCR repertoire diversity measured with deep and normalized sequence profiling. J. Immunol. 2014 Mar 15;192(6):2689-98. doi: 10.4049/jimmunol.1302064. Epub 2014 Feb 7. http://www.jimmunol.org/content/192/6/2689.long
5. Greenstein BD, Fitzpatrick FT, Adcock IM, Kendall MD, Wheeler MJ. Reappearance of the thymus in old rats after orchidectomy: inhibition of regeneration by testosterone. Journal of Endocrinology. 1986;110:417-422. http://joe.endocrinology-journals.org/content/110/3/417.long
6. Windmill KF, Lee VW. Effects of castration on the lymphocytes of the thymus, spleen and lymph nodes. Tissue Cell. 1998;30:104-111.http://www.sciencedirect.com/science/article/pii/S0040816698800116
7. Heng TS, Goldberg GL, Gray DH, Sutherland JS, Chidgey AP, Boyd RL. Effects of castration on thymocyte development in two different models of thymic involution. J Immunol. 2005;175:2982-2993. http://www.jimmunol.org/content/175/5/2982.long
8. Taub DD, Murphy WJ, Longo DL. Rejuvenation of the aging thymus: growth hormone-mediated and ghrelin-mediated signaling pathways. Curr Opin Pharmacol. 2010http://www.sciencedirect.com/science/article/pii/S1471489210000512
9. Shan SN, Nyby JG. Ghrelin’s quick inhibition of androgen-dependent behaviors of male house mice (Mus musculus). Horm Behav. 2010 Mar57(3):291-6.http://www.sciencedirect.com/science/article/pii/S0018506X09002803
10. Bertoldi ML, Luque EM, Carlini VP, Vincenti LM, Stutz G, Santillan ME, Ruiz RD, Fiol de Cuneo M, Martini AC. Inhibitory effects of ghrelin on sexual behavior: role of the peptide in the receptivity reduction induced by food restriction in mice.Horm Metab Res. 2011 Jun;43(7):494-9. https://www.thieme-connect.com/DOI/DOI?10.1055/s-0031-1277228