Клеточная терапия - одно из наиболее перспективных направлений медицины. Замещение поврежденных или не функционирующих клеток может стать методом лечения болезней, на сегодняшний день считающихся неизлечимыми. В целом клеточную терапию можно разделить на несколько направлений: трансплантация клеток-предшественников, взрослых стволовых клеток, трансплантация дифференцированных клеток, готовых к выполнению своих функций, и трансплантация генетически модифицированных клеток с исправленными дефектами. Сейчас использование клеточной терапии в практике ограничивается переливанием крови и трансплантацией костного мозга.
Для широкого применения клеточной терапии в лечении заболеваний необходимо решить несколько проблем. Во-первых, введение чужеродного клеточного материала вызывает иммунологическое отторжение. При переливании крови следят за совместимостью группы крови и резус-фактора донора и пациента. При пересадке органов и костного мозга приходится учитывать совпадение антигенов главного комплекса гистосовместимости, что существенно ограничивает возможность вовремя найти донора. И даже при использовании «совместимого» материала реципиенты вынуждены принимать иммунодепрессанты в течение всей жизни.
Во-вторых, возможность получить клетки донора физически ограничена - доступны лишь некоторые клеточные типы - например, клетки костного мозга, но доступное количество даже этих клеток может быть недостаточным для лечения. Если же говорить про нейроны, гепатоциты и другие специализированные клетки, то их практически невозможно получить. В-третьих, дифференцированные клетки взрослого организма чаще всего уже неспособны к делению, находятся в своей клеточной нише и непригодны для пересадки.
Заболевания нервной системы, связанные с нарушением функционирования и гибелью нейронов, такие как болезни Альцгеймера и Паркинсона, в настоящее время не поддаются лечению. Рассеянный склероз - болезнь, связанная с демиелинизацией аксонов в центральной и периферической нервной системе, также неизлечима. В то же время известно, что, например, признаком болезни Паркинсона является гибель дофаминергических нейронов в черной субстанции среднего мозга, а при рассеянном склерозе выработку миелина прекращают олигодендроциты. Клеточная терапия и трансплантация функциональных нейральных клеток могут быть перспективным подходом для лечения таких заболеваний.
Ниже будут рассмотрены различные способы получения нейральных клеток для клеточной терапии, перспективы применения и имеющиеся проблемы.
Клеточная судьба, и как ее изменить
Всё разнообразие типов клеток в нормальном развитии - нейроны, клетки кожи, крови, печени и другие - формируется в результате деления и дифференцировки одной клетки - зиготы. Зигота образуется при слиянии гамет - ооцита и сперматозоида. Затем в результате клеточного деления формируется группа клеток - морула. Далее образуется полость - бластоцель; эта стадия эмбрионального развития называется бластоцистой. Наружные клетки - трофобласт - будут участвовать в имплантации и формировании плаценты, а из внутренней клеточной массы разовьются все типы клеток эмбриона. Эмбриональное развитие можно представить как дерево, в основе которого лежит одна клетка (зигота), а ветви, отходящие от ствола, символизируют последовательную дифференцировку клеток. Аналогия со стволом удобна еще и тем, что из клеток внутренней клеточной массы получают эмбриональные стволовые (ЭС) клетки, о которых пойдет речь дальше. Клетки внутренней клеточной массы - недифференцированные: они способны стать клетками любого типа. Каждое ветвление дерева - выбор судьбы в процессе дифференцировки, специализация клеток и сужение спектра дифференцировки. Сначала происходит разделение на три зародышевых листка - эндодерму, мезодерму и эктодерму. Можно дополнительно выделить зародышевый путь, будущие гаметы. Очень схематично дальнейшее развитие можно представить как формирование клеток таких органов как почки, лёгкие, желудок из энтодермы; мышц, сердца, селезенки, крови - из мезодермы; нервной системы и эпидермиса - из эктодермы. Способность к делению и дифференцировке в клетки - производные трех зародышевых листков - называется плюрипотентностью. Программа развития осуществляется путем последовательной активации различных групп транскрипционных факторов, которые регулируют экспрессию множества генов. На экспрессию генов влияют как внутренние факторы, так и внешние сигналы, например получаемые от окружающих клеток. Поддержание жизнедеятельности органов и тканей осуществляют взрослые стволовые клетки. Различные типы стволовых клеток уже были рассмотрены на «биомолекуле»: «Ствол и ветки: стволовые клетки» [1].
В экспериментальных системах и в некоторых случаях в нормальном развитии возможно изменение судьбы клеток (рис. 1). Если дифференцировка - превращение недифференцированной клетки в дифференцированную, то обратный процесс называется дедифференцировкой . Превращение одного предшественника клеток в другой - трансдетерминация . Например, в процессе кроветворения гемопоэтические стволовые клетки дифференцируются в предшественников лимфоидного ряда (лимфоцитов и др.) и миелоидного ряда (гранулоциты, макрофаги, эритроциты и др.). Оказалось, что в экспериментальной системе можно вызвать трансдетерминацию - с помощью экспрессии транскрипционных факторов изменить судьбы предшественников миелоидного ряда так, что они дифференцируются в предшественников гранулоцитов и макрофагов, или, в другом эксперименте, в предшественники эритроцитов [2]. И, наконец, недавно была показана прямая дифференцировка - эмбриональные стволовые клетки можно напрямую дифференцировать в нейроны в результате экспрессии определенных транскрипционных факторов. Прямой такая дифференцировка названа из-за того, что обязательные в нормальном развитии стадии дифференцировки в этом случае отсутствуют. Наконец, превращение дифференцированной клетки одного типа в другой без прохождения стадий дедифференцировки - трансдифференцировка.
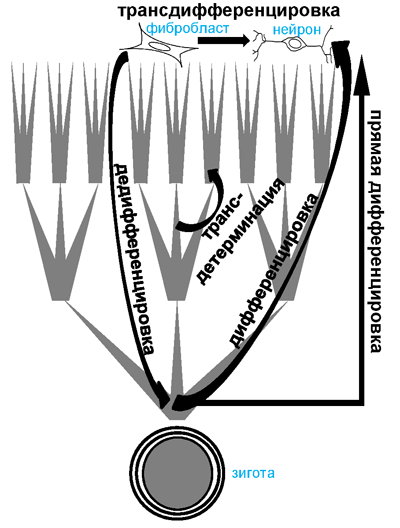
Рисунок 1. Различные пути изменения судьбы клетки.Нормальное развитие - дифференцировка тотипотентной зиготы в различные типы клеток с постепенным сужением потенциала к дифференцировке. В эксперименте можно изменить судьбу клетки - вызвать дедифференцировку, трансдетерминацию или прямую дифференцировку.
Все вышеописанные способы изменения судьбы клетки потенциально пригодны для использования в клеточной терапии. Ниже будут рассмотрены возможности применения этих подходов с акцентом на получении нейральных клеток и использовании относительно нового направления в исследованиях, трансдифференцировки.
Дифференцировка эмбриональных стволовых клеток в нейроны
Клетки внутренней массы бластоцисты в процессе нормального развития дифференцируются во все типы клеток взрослого организма. Оказалось, что эти клетки можно выделить in vitro и размножить в практически неограниченном количестве. Недифференцированные клетки в культуре, способные к неограниченному размножению и в определенных условиях к дифференцировке в специализированные типы клеток, были названы «эмбриональными стволовыми клетками». Впервые ЭС клетки были получены Эвансом и Кауфманом из бластоцист мыши [3]. В 1998 году Томсон получил ЭС клетки человека [4]. Появление плюрипотентных ЭС клеток открыло новые перспективы клеточной терапии. Исследователи смогли получить путем дифференцировки ЭС клеток в различные типы клеток, в том числе и нейроны.
Следует отметить некоторые проблемы, связанные с применением ЭС клеток в медицине. Некоторые люди считают неэтичным разрушение эмбрионов человека даже на такой ранней стадии развития как бластоциста. Недавно было показано, что линии эмбриональных стволовых клеток можно получать и без разрушения эмбриона - из отдельных бластомеров, однако процедура изъятия бластомера может быть не совсем безопасной [5]. В том числе из-за этических проблем число полученных линий ЭС клеток невелико. Это затрудняет использование полученных из ЭС клеток дифференцированных производных в клеточной терапии. Среди небольшого числа линий клеток сложно найти сходные по главному комплексу гистосовместимости, а значит, для большинства пациентов не удастся подобрать иммунологически совместимые трансплантируемые клетки.
Терапевтическое клонирование
Для клеточной терапии желательно использовать пациент-специфические клетки. В идеале это должны быть клетки самого пациента - тогда можно не опасаться иммунологического отторжения. И, конечно же, хотелось бы иметь собственные плюрипотентные клетки для каждого пациента, чтобы иметь возможность получения максимально возможного спектра дифференцированных клеток. Долгое время считалось, что стадия плюрипотентных клеток проходится в раннем эмбриональном развитии и возвращение в прошлое невозможно. Однако Джон Гёрдон показал, что это не совсем так. Оказалось, что если из ооцита лягушки убрать ядро (то есть энуклеировать) и подсадить ядро дифференцированной клетки, можно получить взрослое животное [6]. Это означает, что процесс развития можно обратить назад, вызвав дедифференцировку. Метод переноса ядра дифференцированной клетки в цитоплазму энуклеированного ооцита чаще всего не совсем корректно называют «клонированием». Впервые метод клонирования был успешно применен на млекопитающих в 1997 году, когда была получена овца Долли [7]. Затем были клонированы многие виды млекопитающих. Эффективность клонирования в большинстве случаев менее одного процента, а большинство клонированных животных имеют различные проблемы в развитии.
Помимо возможности создания «копий» животных клонирование потенциально открывает ещё одно перспективное направление. Конечно, клонирование человека недопустимо по этическим соображениям, в том числе и из-за ожидаемых нарушений в функционировании генома [8]. А что если остановиться на раннем этапе эмбрионального развития клона и получить плюрипотентные ЭС клетки из бластоцисты? Получение ЭС клеток путем клонирования было названо терапевтическим клонированием (рис. 2). В теории терапевтическое клонирование позволяет решить проблему получения пациент-специфических клеток. Однако для этого метода также есть ограничения. Впервые ЭС клетки человека удалось получить путем клонирования в 2013 году [9]. Несмотря на достаточно высокую эффективность клонирования, для получения ЭС клеток нужны ооциты высокого качества, а значит, для получения даже одной линии ЭС клеток необходимо использовать много ооцитов. А это, в свою очередь, вызывает морально-этические проблемы. Кроме того, при клонировании ЭС клетки будут иметь митохондрии донора ооцитов. Это может быть плюсом для лечения заболеваний, связанных с мутациями митохондриального генома, но, возможно, другой гаплотип митохондриальной ДНК будет вызывать иммунный ответ. Недавние исследования позволили обойти необходимость использования ооцитов донора для индукции плюрипотентности.
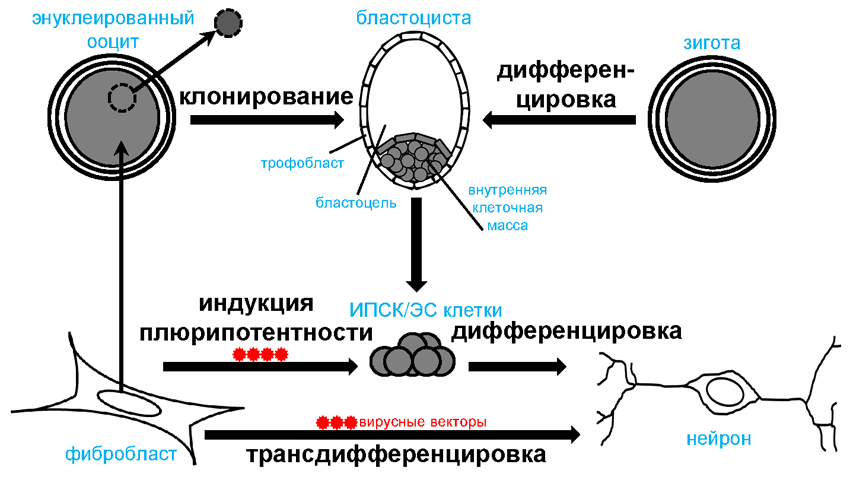
Рисунок 2. Методы изменения судьбы клетки для клеточной терапии. Получение плюрипотентных клеток с последующей дифференцировкой и трансдифференцировка позволяют получить нейроны из фибробластов.
Индуцированная плюрипотентность
Эксперименты по клонированию показали возможность дедифференцировки специализированных клеток. Считается, что цитоплазма ооцита содержит некие репрограммирующие факторы, которые могут изменить функционирование генома дифференцированной клетки и вернуть в плюрипотентное состояние. По-видимому, это какие-то транскрипционные факторы, необходимые для осуществления программы развития. На сегодняшний день неизвестно, какие факторы ооцита обладают репрограммирующей активностью и сколько их. Можно только предположить, что это многокомпонентная система с большим количеством факторов.
Возможность репрограммирования генома дифференцированной клетки при клонировании заинтересовала японского исследователя Синъя Яманака. Если найти репрограммирующие факторы ооцита не удаётся, может быть, можно попробовать подобрать их «с чистого листа»? Яманака установил, что для изменения клеточной судьбы необходимо лишь четыре транскрипционных фактора: Oct4, Sox2, Klf4 и
Таким образом, в настоящее время есть возможность получения пациент-специфических плюрипотентных клеток из клеток кожи. ИПСК практически не отличаются по своим свойствам от ЭС клеток и в то же время их получение не связано с этическими запретами. Как и ЭС клетки, ИПСК можно дифференцировать во многие типы клеток, в том числе нейроны. Казалось бы, технология создания пациент-специфическихплюрипотентных клеток позволит уже завтра использовать клеточную терапию, однако нерешенные проблемы еще остались.
Дифференцировка плюрипотентных клеток in vitro - крайне неэффективный процесс. Хотим ли мы получить из ЭС клеток или ИПСК нейроны, кроветворные клетки или же кардиомиоциты, лишь незначительный процент исходных клеток будет соответствовать ожидаемому типу клеток. Дифференцировка in vitro имитирует нормальный процесс дифференцировки in vivo , наши знания о котором ограничены. Кроме того, при дифференцировке in vitro мы можем добавлять в среду для культивирования различные ростовые факторы, но в большинстве случаев не можем смоделировать клеточное окружение. А ведь для правильной дифференцировки необходимы сигналы окружающих клеток, которые, в свою очередь, зависят от взаимодействия многих типов клеток. Таким образом, даже получив нужную популяцию клеток, мы не можем быть полностью уверены в том, что дифференцировка прошла правильно. Проверить это можно, сравнив профили экспрессии генов в норме и в полученном в результате дифференцировки типе клеток и проверив их функциональность. Такая проверка, конечно, проводится на модельных животных, а не на человеке, и не всегда понятно, можно ли считать, что клетки, доказавшие выполнение своей специализированной функции на модельных животных, будут корректно функционировать в организме человека.
Еще одна проблема - потенциальная онкогенность плюрипотентных клеток. Если плюрипотентные клетки ввести в организм без предварительной дифференцировки, они формируют доброкачественную опухоль (тератому), пытаясь обеспечить эмбриональное развитие, несмотря на отсутствие необходимых сигналов. Неполностью дифференцированные производных плюрипотентных клеток также опасны, поэтому необходимо очень тщательно отделять прошедшие дифференцировку клетки от сохранивших потенциал к развитию. Кроме того, сам процесс репрограммирования может вызывать появление генетических и эпигенетических нарушений [15]. Один из подходов, позволяющих обойти проблему онкогенности, представлен ниже.
Трансдифференцировка: нейрон из фибробласта
После того, как были получены ИПСК, стало ясно, что для изменения судьбы клетки может хватить всего лишь нескольких транскрипционных факторов. Дальнейшее развитие технологии позволило получить ИПСК без интеграции трансгенов доставкой репрограммирующих факторов с помощью модифицированной РНК, безъинтеграционными вирусами или, в недавней работе, с использованием для репрограммирования только набора химических веществ [16]. Таким образом, проблема инсерционного мутагенеза практически решена, однако индукция плюрипотентности увеличивает и онкогенный потенциал клеток. Может быть, можно обойтись без шага индуцированной плюрипотентности и сразу получать желаемый тип клеток?
Многие исследователи сосредоточили свое внимание на получении нейронов с использованием фибробластов в качестве исходного материала для трансдифференцировки. Выбор фибробластов как для дедифференцировки, так и для трансдифференцировки не случаен. Фибробласты - относительно гомогенная популяция клеток, их можно легко получить из взрослого организма, взяв небольшой кусочек кожи и размножив in vitro . Для получения нейронов был использован тот же методический подход, что и для ИПСК. Были отобраны 19 транскрипционных факторов, экспрессия которых выявлена в нейронах, сделаны лентивирусные векторы, несущие гены транскрипционных факторов, и проведено заражение фибробластов мыши. Получив клетки, имеющие маркеры нейронов, исследователи постепенно установили минимальный необходимый набор репрограммирующих факторов: Ascl1, Brn2 и Mytl1 [17]. Полученные нейроны обладали способностью формировать синапсы, а эффективность их получения достигала 19,5%. Нужно отметить, что в этих экспериментах была получена смесь нейронов нескольких типов, то есть такие нейроны пока непригодны для клеточной терапии. В дальнейшем, аналогичным методом были получены нейроны из фибробластов человека, в том числе моторные и дофаминергические нейроны. Одна из проблем этого метода - в большинстве работ эффективность получения нейронов не превышает нескольких процентов, что не дает получить их в достаточном количестве. Но эту проблему решает следующая модификация метода.
Нейральные стволовые клетки из фибробластов
Итак, получение нейронов из фибробластов ограничено количеством фибробластов. Кроме того, использование функциональных нейронов для клеточной терапии затруднительно - нейроны формируют многочисленные отростки, и их уже не удается пересадить без гибели клеток, так как отростки при этом разрушаются. А что, если получать не функциональные нейроны, а нейрональные стволовые клетки? Эти клетки обладают потенциалом как к делению, так и к дифференцировке в основные нейральные типы клеток: нейроны, глию и олигодендроглию. И действительно, было показано, что экспрессия всего одного транскрипционного фактора - Sox2 - позволяет получить и затем размножить in vitro нейрональные стволовые клетки, а при их дифференцировке - нейрональные клеточные типы [18]. По-видимому, именно получение нейрональных стволовых клеток - будущее клеточной терапии.
Проблемы клеточной терапии заболеваний нервной системы
Несмотря на развитие клеточных технологий, остается множество нерешенных проблем. Общая проблема клеточной терапии - отторжение трансплантированного материала иммунной системой. Одно из решений - использование клеток самого пациента после дедифференцировки или трансдифференцировки. Для терапии заболеваний центральной нервной системы пациент-специфические клетки могут и не потребоваться. Мозг является иммунопривилегированным органом, что позволяет трансплантировать клетки, не учитывая гистосовместимость. Следующая проблема связана с выбором клеток для трансплантации. Допустим, in vitro получены дофаминергические нейроны для лечения болезни Паркинсона. При переносе функциональных нейронов клетки, скорее всего, погибнут из-за поломки отростков. Возможное решение - трансплантация клеток-предшественников, которые пройдут последние стадии дифференцировки уже «на месте».
Трансплантация нейрональных клеток в мозг имеет и другие подводные камни. Не совсем понятно, сколько введенных клеток выживет после переноса. Кроме того, они трансплантируются в систему, в которой связи между клетками уже сформированы. Смогут ли введенные нейроны сформировать новые связи с окружением и корректно функционировать в этой системе? Также, остается проблема возможной онкогенности вводимых клеток.
И, тем не менее, в настоящее время клеточная терапия всё ближе продвигается к практическому применению. Современные клеточные технологии позволяет получать многие типы клеток и даже органы in vitro . Так, из плюрипотентных клеток мыши в 3D культуре было выращено внутреннее ухо [19] и аналог глазного бокала [20]. Эксперименты на модельных животных показывают принципиальную возможность использования клеточной терапии для лечения некоторых заболеваний. Однако для широкого применения новых технологий в медицине необходимо решить большое количество этических и методических проблем.