Исследования по стволовым клеткам перешли в тот разряд науки, о котором можно запросто прочитать в газете в руках у соседа, сидящего рядом с вами в метро. Интерес к этой тематике возник, конечно, не с пустого места: никогда ещё человечество не было так близко к извечно вожделенному бессмертию, как в век молекулярной биологии. (По крайней мере, так это представляется журналистам, пропагандирующим современные достижения «в народе».) С помощью стволовых клеток нам обещают как минимум излечение от большинства болезней, регенерацию органов, трансплантацию без отторжения, персональную медицину, и, конечно, молодость и красоту. И эти обещания отнюдь не беспочвенны: чего стоит хотя бы эксперимент, в котором стволовые клетки, используя в качестве строительных лесов каркас сéрдца мёртвой крысы, состоящий лишь из соединительной ткани, полностью достраивают орган до вновь рабочего состояния [1]! Или, например, очень хороша другая работа, в которой эмбриональные стволовые клетки развились в сферическое двухмиллиметровое образование из нервной ткани, очень напоминающее мозг на ранних стадиях развития [2]. А ведь кроме представляющейся пока совершенно фантастической индустрии выращивания для себя «запасных» органов, можно назвать и более прозаические применения: например, терапия стволовыми клетками сердечной ткани после инфаркта, позволяющая избавиться от рубца в миокарде, оставшегося бы иначе до конца жизни. Кроме собственно лечения больных, стволовые клетки найдут (и уже находят) применение в области тестирования новых лекарств на эффективность и токсичность, а также для изучения редких генетических заболеваний на специальных «моделях», созданных при помощи СК. Смело в будущее смотрят и многие косметологи: уже сейчас нередко встретишь заявления о чудесах, производимых
Термин «стволовая клетка» (СК) был введён в науку не вчера: на заседании Общества гематологов, состоявшемся 1 июня 1909 года в Берлине, русский гистолог Александр Максимов назвал так клетки крови, которые способны дать начало нескольким другим типам клеток. (В связи с тем, что в те времена официальным языком науки был немецкий, а не английский, как сейчас, это слово звучало как "Stammzelle".)
Корнем иерархии стволовых клеток (да и всех остальных клеток организма тоже) является зигота - самая первая клетка, являющаяся продуктом слияния яйцеклетки и сперматозоида. Зиготу и несколько её поколений (в течение первых нескольких дней эмбрионального развития) называют тотипотентной клеткой , то есть способной дать начало абсолютно любой ткани и органу, да и всему организму. (Кстати, однояйцевые близнецы - это как раз случай, когда зигота даёт начало не одному, а сразу двум или нескольким, генетически идентичным, организмам.) Ветвями иерархии являются плюрипотентные и мультипотентные (бластные) стволовые клетки, а «листьями» - зрелые дифференцированные ( унипотентные ) клетки тканей организма. Зрелые клетки запрограммированы на ограниченное количество циклов деления, после чего они умирают, замещаясь новыми поколениями; стволовые клетки такого ограничения не имеют и могут делиться бесконечно, поддерживая пулы стволовых и дифференцированных клеток. Впрочем, с возрастом популяция стволовых клеток сокращается: если в эмбриональном развитии одна ЭСК приходится на 10000 дифференцированных клеток, то у человека
Генетически все клетки организма (кроме половых) идентичны друг другу*, а вся разница в их строении и, следовательно, функциях (а также способности делиться и дифференцироваться) определяется режимом работы (экспрессии) генов, различающимся в клетках разных тканей. Дифференцировка клеток управляется цитокинами - химическими сигналами (молекулами), выделяемыми другими клетками.
* - Строго говоря, это не совсем так (у эритроцитов вообще нет ядра, у некоторых организмов геномы соматических клеток подвергаются значительным «сокращениям», мобильные элементы генома в разных клетках могут перемещаться
Итак, наиболее существенными характеристиками стволовых клеток (для определённости возьмём ЭСК) являются:
- Тотипотентность - способность развиваться в клетку любой из более чем 350 тканей организма;
- Хоуминг - способность «ощущать» градиенты хемокинов и мигрировать в зону повреждения или активного деления, восстанавливая поражённые участки или принимая участие в развитии;
- Избыточность экспрессии генов - в цитоплазме одновременно находится более 3000 мРНК, которые могут потребоваться только на более поздних стадиях развития зародыша;
- Теломеразная активность . При репликации ДНК концевые участки хромосом ( теломеры ) неконтролируемо укорачиваются, в конце концов затрагивая и повреждая структуру генов - что может быть одним из естественных механизмов ограничения числа циклов деления и даже причиной старения вообще. Однако в стволовых клетках действует теломераза - фермент, удлиняющий теломеры и тем снимающий ограничения по делению. (В этом смысле стволовые клетки очень похожи на раковые, которые также способны неограниченно делиться, - только последние отнюдь не способствуют долголетию.)
Чем плохи эмбриональные стволовые клетки?
Как уже было сказано во введении, эмбриональные стволовые клетки (ЭСК) являются идеальным образцом тотипотентности, то есть неограниченной способности к делению и дифференцировке. Однако если рассуждать с прицелом на практические применения - такие как регенеративная медицина или выращивание «запасных» тканей и органов - то главным ограничением в исследованиях становится хорошо известная этическая проблема, связанная с ЭСК: чтобы получить их, надо «отщипнуть» кусочек от эмбриона, почти наверняка прервав зарождающуюся жизнь. Проблема эта стоит настолько остро и имеет такие строгие законодательные ограничения, что исследователи часто не могут работать с человеческими ЭСК, даже если для этого не нужно совершать ничего аморального: если, например, в качестве образцов использовать не потребовавшиеся при экстракорпоральном оплодотворении (ЭКО) зародыши, заручившись на то согласием пациентов. Особенно суров на этот счёт закон США: Джордж Буш лично запретил, дважды воспользовавшись правом вето в конгрессе, государственное финансирование любым работам, в которых могут быть разрушены человеческие эмбрионы.
Впрочем, новый президент США Барак Обама, видимо, уже дал законодательное послабление: летом 2009 года начнутся первые испытания по применению стволовых клеток для лечения больных. Около десяти парализованных пациентов в одной из американских клиник получат спинномозговую инъекцию стволовых клеток - предшественников олигодендроцитов (один из типов клеток центральной нервной системы). Этот метод уже был опробован на лабораторных животных, и через полгода станет ясно, поможет ли он людям [3].
Недавно появились данные, что ЭСК можно получать из зародышей, не разрушая их: если от эмбриона на стадии четырёх или восьми клеток отделить один из бластомеров, то из него можно получить линию ЭСК, а зародыш тем временем продолжит развитие, по крайней мере, до стадии бластоцисты [4]. (Дальнейшее наблюдение не проводилось исходя из всё тех же этических соображений.) И хотя, очевидно, способ не повреждающего эмбрионы получения ЭСК существует - ведь описанная процедура практически ничем не отличается от изъятия одного бластомера для генетического скрининга при ЭКО, - многочисленные этические проблемы и сопротивление общественного мнения вряд ли обещают этой методике большое будущее.
Скорее всего, прогнозируемый в ближайшее десятилетие прорыв в передовой медицине, связанный со стволовыми клетками, будет основан не на ЭСК, а на так называемых индуцированных плюрипотентных стволовых клетках (ИПСК, от Induced Pluripotent Stem Cell) - обычных дифференцированных зрелых клетках, перепрограммированных в состояние плюрипотентности.
Сюрпризы стволовых клеток
Л. И. Корочкин - крупнейший русский биолог, один из основателей генетики развития и видный специалист по стволовым клеткам - в 2005 году писал в популярной статье о стволовых клетках: «...изучение поведения стволовых клеток не поколебало представлений о стабильности и необратимости клеточной дифференцировки: из фиброцита, плазматической или из париетальной клетки желудка никогда не получится нейрон, а из нейрона не возникнет кожная клетка. <...> На стадии терминальной дифференцировки клетка обретает стабильное состояние и теряет способность к делению и разного рода превращениям» [5]. Всего одного года Леонид Иванович не дожил до события, которое, несомненно, поразило бы его до глубины души: в 2007 году в поле зрения журнала Science , опять опубликовавшего рейтинг важнейших открытий (на этот раз - только за истекший год), попало две работы, в которых докладывалось о получении индуцированных плюрипотентных стволовых клеток (ИПСК) из зрелых, дифференцированных клеток - при помощи своего рода генетического перепрограммирования.
Транскрипционные факторы и гены, участвующие в работе стволовых клетокOct3/4 (Octamer-binding transcription factor 4) - белковый транскрипционный фактор (ТФ) семейства гомеобокс, играющий ключевую роль в раннем эмбриональном развитии. Необходим для поддержания плюрипотентности стволовых клеток. Нарушение его работы приводит к тому, что на стадии бластоцисты не формируется эмбриобласт, а это ведёт к ранней летальности. Во взрослом организме этот ген практически неактивен, за исключением некоторых стволовых популяций и опухолевых клеток. Sox2 (SRY [sex determining region Y]-box 2) - белковый ТФ семейства SOX, связывающийся с малой бороздкой ДНК и также играющий решающую роль в раннем эмбриональном развитии и самоподдержании популяции СК. Мутация этого гена приводит к врождённым порокам развития, таким как отсутствие одного или обоих глаз. NANÓG - ещё один гомеобоксный ТФ, лежащий в основе плюрипотентности. «Выключение» этого гена приводит к запуску дифференцировки СК. Первооткрыватель этого фактора шотландец Йэн Чемберс ( Ian Chambers ) так говорит об истории его наименования: «Похоже, Nanog - один из основных генов, определяющих возможности стволовых клеток по неограниченному росту в лаборатории и в организме. Поскольку я шотландец, я назову этот ген в честь старинной легенды о Тир-На-Ноге...» . (Тир-На-Ног (иногда Тир-На-Ног’т) - земля вечной молодости в кельтской мифологии.) Klf-4 ( Krüppel-like factor 4) - ТФ семейства, названного так Lin28 - ещё один маркер активности стволовых клеток - мРНК-связывающий и микро-РНК регулируемый белок, способный селективно усиливать трансляцию мРНК. В частности, при его участии проходит синтез инсулиноподобного фактора роста (IGF2), очень важного в эмбриональном развитии и в формировании мышц. Активность гена наблюдается в эмбриональных тканях, стволовых клетках и мышцах и миокарде во взрослом организме. |
Гистоновый код и метилирование ДНКДНК в хромосоме плотно упакована, что достигается путём «наматывания» молекулы ДНК на «бобину» из белковых молекул - гистонов . Как сама молекула ДНК, так и белки-гистоны несут особые химические «метки», маркирующие данный участок хромосомы как активный (экспрессия генов разрешена) или неактивный (репрессированный). Узнавание нужных участков хромосомы и распределение на этом участке меток осуществляется широким спектром различных ферментов в составе крупных белковых комплексов. Такие комплексы порой содержат молекулы коротких РНК, которые нацеливают комплекс на участок ДНК, комплементарный последовательности короткой РНК. Метилирование ДНК по цитозиновым основаниям без изменения самой последовательности нуклеотидов является одним из механизмов эпигенетического регулирования активности генов; оно производится ферментами, носящими название ДНК-метилтрансфераз. Гистоны же имеют на поверхности множество заряженных аминокислотных остатков (таких как лизин или глутаминовая кислота), которые могут подвергаться разнообразным модификациям - метилированию, фосфорилированию, ацетилированию и другим. Система этих модификаций чрезвычайно важна для регуляции активности генов, и даже получила название «гистоновый код» [8]. |
Пионером в этой области можно считать японского биолога Шинью Яманаку (Shinya Yamanaka) из Университета Киото, группа которого первой сообщила о своих результатах в журнале Cell [6]*. Исследователям удалось превратить фибробласты из кожи человека в клетки, очень напоминающие ЭСК по морфологии, экспрессии генов и способности к дифференцировке. Сделано это было при помощи ретровирусной интеграции (или, как говорят, трансфекции ) в геном фибробластов четырёх транскрипционных факторов (ТФ) - Oct3/4, Sox2, Klf4 и
* - Строго говоря, первой была не эта их статья, но именно она отмечена в Science .
Чтобы «помочь» клеткам перестроиться на новый лад, их культивируют в среде особого состава, заменяя её через
Чтобы убедиться, что полученные клетки действительно обладают широкой способностью к дифференциации, было продемонстрировано их превращение в клетки всех трёх зародышевых листков - в частности, в нервные клетки или кардиомиоциты, демонстрирующие в культуре биение (способность к коллективному восприятию электрического стимула и реакции на него). Кроме того, тотипотентные свойства ИПСК были проиллюстрированы на примере образования опухолей - тератом - у инъецированных этими клетками мышей с генетически ослабленным иммунитетом (это является стандартным «тестом на стволовую клетку»).
Механизм действия этой «магической комбинации» перепрограммирующих белков до конца ещё не понятен, однако известно, что два из использованных факторов - Oct3/4 и Sox2 - лежат в основе плюрипотентности стволовых клеток, активно работая именно в них (но не в соматических клетках). Они активируют «стволовые и эмбриональные» гены в клетке, заставляя гены, отвечающие за специализацию, наоборот, сократить свою активность. Известно также, что эти белк и не могут запустить превращение зрелой клетки самостоятельно - видимо,
Интересно, что в уже окончательно «де-дифференцировавшихся» стволовых клетках активность генов, доставленных с помощью ретровирусных векторов и вызвавших это превращение, сильно падает, и, похоже, больше не требуется для поддержания ИПСК в «стволовом» состоянии. Это обстоятельство позволяет надеяться, что удастся найти способ перепрограммировать зрелые клетки в состояние тотипотентности без интеграции в ДНК транскрипционных факторов под управлением вирусных промоторов, два из которых, использованных Яманакой, являются протоонкогенами:
* - «Выращивание» мышей из стволовых клеток путём подсаживания их в эмбрион и последующего скрещивания «мозаичных» мышей для получения чистых трансгенных линий - метод, отмеченный Нобелевской премией 2007 года [7] как получивший чрезвычайно широкое распространение в молекулярной биологии.
Необходимо отметить, что
Дополнительным источником мутаций может служить интеграция генетического материала в ДНК человеческих клеток (путём рекомбинации с хромосомами), и, скорее всего, пока не будет найден способ перепрограммировать клетки без трансфекции - только за счёт разовой обработки набором каких-либо факторов - использование таких СК в медицине будет очень ограничено.
Обойдёмся без онкогенов
Учёные хорошо понимают, что успех разрабатываемых ими технологий перепрограммирования соматических клеток в стволовые зависит от того, насколько безопасным будет их применение. В первую очередь опасения тут касаются, конечно, онкогенного действия генов
Всего несколько месяцев спустя Яманака и его группа докладывают о том, что им удалось получить стволовые клетки без одного из онкогенов, который они использовали раньше, -
Ещё в одном исследовании, вместе с работой Яманаки отмеченном в Science как один из «прорывов» 2007 года, учёные независимо добились сходных результатов - индуцировали превращение фибробластов человека в стволовые клетки, по основным параметрам практически неотличимые от ЭСК [10]. В этой работе использовались другие индуцирующие факторы, комбинацию которых подобрали из набора генов, активных только в эмбриогенезе и в культурах стволовых клеток. Из списка «претендентов» заранее исключили
Питательная среда, в которой культивируются клетки, может оказывать не меньшее влияние на ход перепрограммирования, чем белки-индукторы плюрипотентности. Так, совсем недавно обнаружилось, что низкомолекулярное соединение вальпроевая кислота , часто используемая как лекарство против эпилепсии, может применяться вместо онкогенного фактора Klf-4 при получении ИПСК [11]. При добавлении в среду, в которой выращивали фибробласты человека, вальпроевой кислоты и трёх ТФ - Sox2, Oct4 и
Стволовые клетки из вóлоса
В большей части упомянутых исследований ИПСК получали путём перепрограммирования фибробластов (в случае исследований на человеческих клетках), а для мышей были успешные примеры и для нейронов. Но недавно Хуану Карлосу Бельмонте ( Juan Carlos Belmonte ) из Института биологических исследований Солка в Калифорнии и объединённой группе итальянских и испанских биологов удалось показать, что кератиноциты - клетки рогового слоя и волос - значительно лучше подходят для перепрограммирования, чем «привычные» фибробласты. В своей работе (правда, использовался «полный» набор индукторов - Oct4, Sox2,
«При условии доступности эффективного и практически приемлемого метода получения стволовых клеток, специфичных для каждого пациента - а эти условия явно не выполняются в случае эмбриональных стволовых клеток, - клеточная терапия и трансплантация не будут вызывать отторжения иммунной системой, что значительно приблизит нас к реальному применению стволовых клеток в клинике» , - говорит Бельмонте, который по совместительству является директором Центра регенеративной медицины в Барселоне [13].
Учёные объясняют такую высокую эффективность перепрограммирования не столько выбранной ими системой и протоколом ретровирусной трансфекции, сколько выбором именно кератиноцитов в качестве объекта для «превращений». Проведённый ими статистический анализ профилей генетической активности фибробластов, кератиноцитов и ЭСК позволил заключить, что кератиноциты
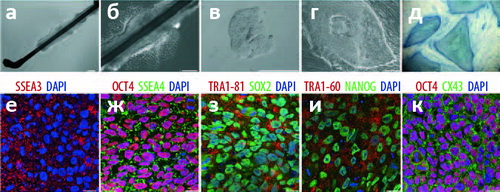 |
|
Рисунок 1. Получение и характеристика индуцированных плюрипотентных клеток из кератиноцитов (КиПСК). (а) Волос из кожи головы человека, помещённый на желатинообразную питательную среду матригель , смоченную средой, предназначенной для культивирования стволовых клеток. (б) Разрастание кератиноцитов в питательной среде со ствола волоса (но не с луковицы) становится отчётливо заметным через 5 дней. Через три дня после этого кератиноциты «пересадили» в отдельную чашку, ещё через три дня - трансфецировали ретровирусной конструкцией, содержащей гены Oct4, Sox2, |
В своей работе биологи продемонстрировали эффективность предложенной ими методики как нельзя более изящно: вместо использования культур клеток, чашек Петри и прочего сугубо лабораторного реквизита, они взяли просто волос с головы одной из участниц исследования, и продемонстрировали образование ИПСК в области стержня волоса (а не луковицы; см. рис. 1). Этот эксперимент подтверждает, что исследователи наблюдали именно перепрограммирование кератиноцитов, а не разрастание колоний СК, присутствующих в корне волоса (хотя косвенное их влияние и не исключено). Полученные клетки, как и положено, дифференцировались в представителей зрелых специализированных клеток всех трёх зародышевых листков, включая дофаминегрические нейроны (см. рис. 2) и кардиомиоциты, совершающие коллективные биения в культуре (см. видео). При «де-дифференцировке» клетки начисто «забывали» свой прежний облик и переставали синтезировать маркерный белок кератиноцитов -
«Почему именно кератиноциты оказались наиболее податливыми к перепрограммированию, чем все остальные клетки из массы, перепробованной нами - это большой вопрос» , - говорит Бельмонте [13]. - «Однако знание этой причины чрезвычайно важно для дальнейшего развития и науки, и технологии».
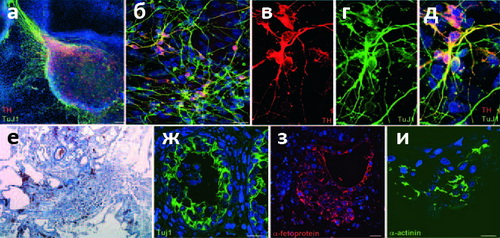 |
|
Рисунок 2. КиПС клетки дифференцируются в ткани всех трёх зародышевых листков как in vitro , так и in vivo . (а) Дифференциация в среде стромальных клеток линии PA6 при добавлении фактора роста фибробластов |
|
Видеозапись в реальном времени: биение кардиомиоцита, развившегося из стволовой клетки, полученной путём «перепрограммирования» клетки человеческого волоса (кератиноцита). Видео из дополнительной информации к статье [12]. |
Стволовые клетки без трансфекции
Исследования в области получения индуцированных плюрипотентных стволовых клеток из «обычных» соматических идут семимильными шагами, и уже не остаётся сомнения, что вскоре эта задача будет решена окончательно. (Правда, останется намного более фундаментальная проблема: как полученными ИПСК пользоваться!) Так, например, совсем недавно группа учёных из Исследовательского института Скриппса (Калифорния, США) и Института молекулярной биомедицины имени Макса Планка (Мюнстер, Германия) сообщила, что им удалось получить СК с использованием всего двух ТФ, заменив остальные низкомолекулярными веществами. Однако самое интересное заключается в том, что в списке «замещённых» генов числится Sox2, который считался абсолютно необходимым для перепрограммирования [14]!
«Наша работа доказывает, в конце концов нам удастся перепрограммировать соматические клетки в стволовые только при помощи химической обработки, и вообще без генетических манипуляций» , - говорит Шенг Динг ( Sheng Ding ), профессор кафедры химии в институте Скриппса и руководитель исследования [15]. - «Учитывая вклад ряда других рабочих групп, с уверенностью можно сказать, что технология клеточного перепрограммирования вскоре станет неотъемлемой частью практически важных приложений».
Коллектив, возглавляемый Дингом, открыл два низкомолекулярных гетероциклических соединения, которые позволяют провести перепрограммирование без интеграции гена Sox2. «Действующее вещество» этой пары - известное под кодовым названием BIX - является (как и вальпроевая кислота, речь о которой уже шла) ингибитором гистон-ацетилтрансферазы и ДНК-метилтрансферазы - ферментов-регуляторов структуры хроматина и активности генов. Однако сам по себе BIX обеспечивает очень низкую эффективность перепрограммирования, и учёным посчастливилось идентифицировать второе соединение - известное под шифром BayK8644 - которое, никак само не влияя на активность генов (!) и являясь агонистом кальциевых каналов мембраны клетки, позволяет существенно увеличить выход процесса. Почему это происходит, пока ещё точно не известно.
«Нам пока что не удалось установить точный механизм, по которому BayK ускоряет перепрограммирование» , - признался Динг [15]. - «Мы не ожидали открыть, что маленькая молекула, влияющая на передачу сигналов и, вроде бы, никак не связанная с плюрипотентностью, может так её „катализировать". Это может в дальнейшем позволить перепрограммировать клетку без нарушения её генетической целостности прямо in vivo ».
Ну и напоследок следует рассказать о совсем свежей работе группы Яманаки, которой, похоже, удалось-таки осуществить клеточное перепрограммирование без интеграции ретровирусов в геном [16]. Вместо ретровируса исследователи использовали аденовирус, на основе которого соорудили две плазмиды - одну с генами Oct3/4, Sox2 и
Пока что эффективность подобного перепрограммирования, опять-таки, существенно ниже, чем при использовании ретровирусов, да и сам принцип был продемонстрирован не на клетках взрослого человека, а на эмбриональных фибробластах мыши. Однако первый недостаток, возможно, связан всего лишь с более низким уровнем экспрессии генов с плазмиды, чем с встроенного в хромосому фрагмента ДНК, - и в этом случае наверняка удастся найти выход путём оптимизации протокола обработки клеток. А в том, что и на человеческих клетках удастся сделать то же самое - уже и сомневаться не приходится.
Заключение
Перспективность исследований в области стволовых клеток ни у кого не вызывает сомнений - не даром известный южнокорейский учёный У Сук Хван (Woo Suk Hwang), в надежде закрепить свой приоритет в этой области, не удержался от соблазна и опубликовал в 2005 году в Science преднамеренно фальсифицированные результаты относительно получения ЭСК путём «пересадки» ядра соматической клетки в неоплодотворённую яйцеклетку, а не из безжизненного эмбриона. Подтасовка в такой активно развивающейся области была, конечно, очень скоро обнаружена [17], и репутация исследователя теперь безнадёжно испорчена, но область в целом с тех пор существенно продвинулась вперёд, и, как видно из этого обзора, учёные уже практически стоят на пороге технологии получения стволовых клеток, которая устроила бы всех. (За исключением, конечно, только самых ярых противников любых молекулярно-генетических работ, являющихся по некоторым данным смертным грехом [18].)
И - уже в который раз - работы, связанные со стволовыми клетками, называют прорывом года. По версии журнала Science , как и многих других изданий, «перепрограммирование» соматических клеток в стволовые (и в соматические клетки другого типа, минуя «стволовую» стадию), открытие специфики кератиноцитов в этом отношении и первые работы, позволяющие обходиться без модификации генома, - это одни из самых важных достижений 2008 года [19].
Однако самое интересное ещё, конечно, впереди: мало получить ИПСК и на модельной системе продемонстрировать, что стволовые клетки могут формировать органы, - надо ещё научиться эти органы трансплантировать нуждающимся в этом пациентам. По данным лабораторных исследований, иммунологического отторжения не должно происходить, однако реальность всегда вносит свои коррективы, и задача может оказаться намного сложнее, чем можно себе представить. Точно так же, пока стволовые клетки смогут быть использованы в «омолаживающих» косметических продуктах, наверняка придётся преодолеть ещё массу сложностей и убедительно доказать, что игра с таким мощным инструментом, как стволовая клетка, не причинит вреда здоровью человека (например, ни при каких условиях не запустит процесс возникновения опухоли).
Первая ниша, которую стволовые клетки займут в практически важной деятельности уже в самое ближайшее время - это изучение редких генетических заболеваний на культурах СК, обладающих генотипом, обуславливающим болезнь. Многие болезни не удаётся как следует изучить оттого, что они крайне редко встречаются, и пациентов с этим заболеванием оказывается по ряду причин не просто привлечь к исследованию. Создание «моделей» этих заболеваний, основанных на стволовых клетках, позволит преодолеть это ограничение и более подробно изучить болезни.
Стволовые клетки найдут применение и в области тестирования лекарств и других биологических препаратов, позволяя быстро и эффективно исследовать влияние различных веществ на клетки различных типов, предсказывая тем самым спектр активности будущего препарата в разных тканях и органах.
Нейродегенеративные заболевания, такие как болезни Паркинсона и Альцгеймера, тоже «дожидаются» пришествия стволовых клеток - существуют обнадёживающие данные, что они позволят значительно сдерживать заболевание и даже обращать вспять вызванные им разрушительные изменения.
Первоначально статья была опубликована в журнале Косметика и медицина [20].